5 Trajet de prédialyse
Motivation (KPI) : De nombreuses études et directives soulignent depuis des années l’importance majeure d’une information opportune et complète des patients sur les différentes options concernant le traitement de l’insuffisance rénale chronique terminale (Owen et al. 2006; Finderup et al. 2020). La cartographie de la comorbidité, de la qualité de vie et de la fonctionnalité des patients de plus de 70 ans souffrant d’insuffisance rénale chronique des stades 4 et 5 est essentielle. Il est préférable d’utiliser des échelles validées, comme le prévoient les directives néerlandaises (« Nierfunctievervangende behandeling » 2024). Ceci a également été retenu dans la directive KDIGO 2024 : “Practice Point 5.3.1: Enable access to a patient-centered multidisciplinary care team consisting of dietary counseling, medication management, education, and counseling about different KRT modalities, transplant options, dialysis access surgery, and ethical, psychological, and social care for people with CKD.” (Stevens et al. 2024).
Actuellement, aucun cadre juridique ni aucune directive scientifique nationale n’ont été établis pour un trajet de prédialyse. Nous avons dès lors dressé un aperçu de la situation actuelle basé sur les visites d’audit sur place.
Au moment de l’audit sur place, pratiquement tous les hôpitaux avaient mis en pratique plusieurs éléments d’un trajet de soins. Pourtant, seuls 17 sur les 24 hôpitaux visités (71 %) ont pu présenter un trajet ou un parcours de soins écrit. Nous allons maintenant approfondir les aspects de contenu des items suivants.
5.1 Éducation des patients
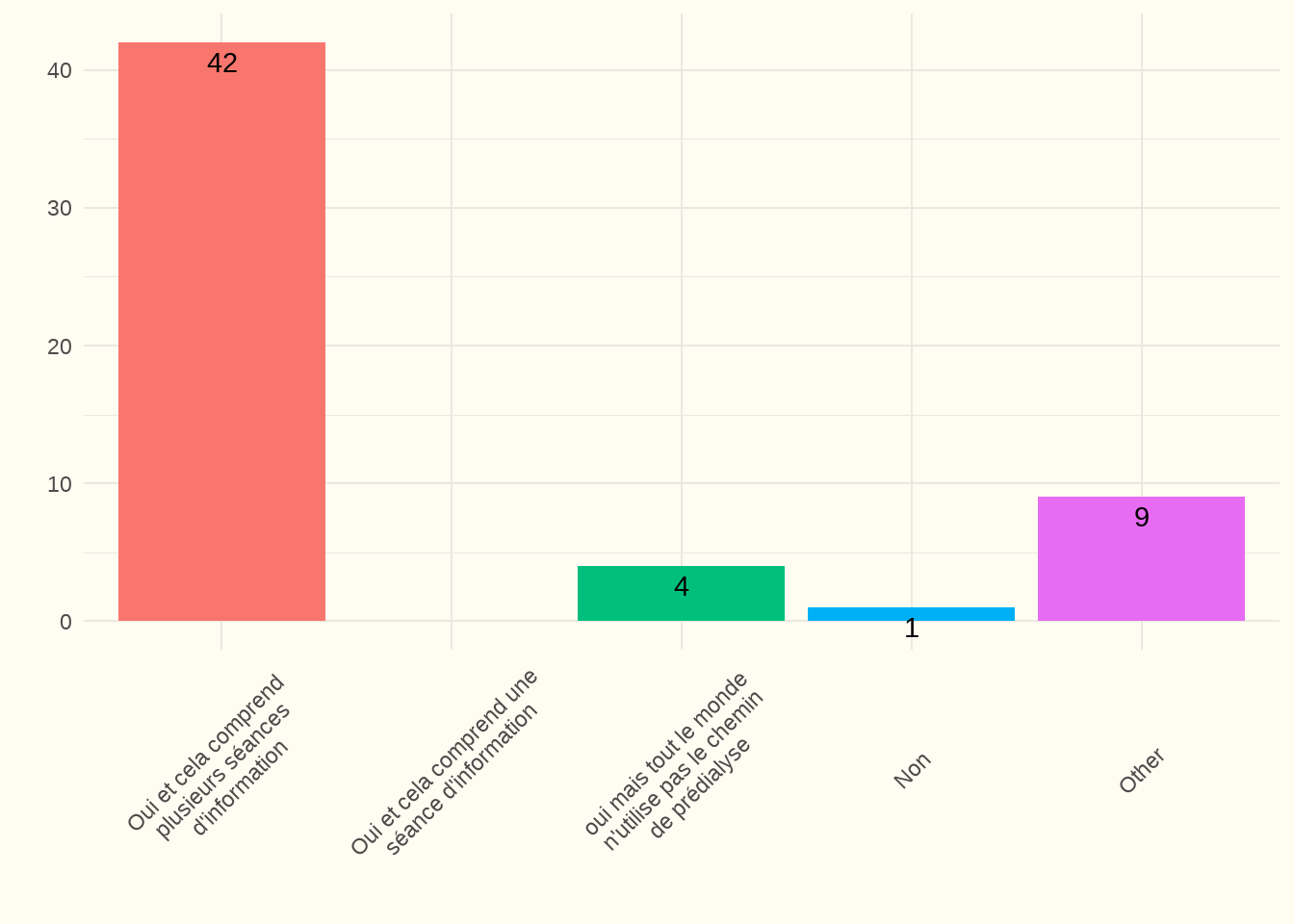
5.1.1 Votre service utilise-t-il un trajet de prédialyse multidisciplinaire (avec au moins un diététicien et un infirmier) ? (EL)
Motivation (KPI) : “Ensuring that patients with advanced Chronic Kidney Disease (CKD) have access to interdisciplinary pre-dialysis care is almost a precondition for patient centered care, since it is in such environments that patient and family education can best be achieved, and joint decision making employed regarding such matters as dialysis modality choice or choosing conservative care only.” (Bear et Stockie 2014). De plus, Devoe et al. (2016) ont montré une forte association entre la dispense d’une éducation opportune et appropriée du patient et la proportion de DP par rapport à l’HD. Ce qui est important dans ce cadre, la mise en place d’un trajet éducatif sérieux et structuré ; “Through process redesign, more of our patients are known to us before commencement of dialysis, a greater proportion of which are provided with pre-dialysis education and permanent vascular access. Our results highlight that implementation remains the final and most difficult challenge of the guideline process” (Owen et al. 2006). Enfin, du point de vue du patient, il existe des différences très importantes entre les options de traitement : “ Patients with kidney failure experience a complex decision on dialysis modality performed either at home or in hospital. The options have different levels of impact on their physical and psychological condition and social life.” (Finderup et al. 2020).

Constatation : 81 % des centres ont déclaré avoir organisé un trajet de prédialyse multidisciplinaire comprenant plusieurs moments d’information et que tout le monde (tous les prestataires de soins du centre) l’utilisait. Dix centres ont déclaré n’avoir rien ou avoir autre chose. Tous les centres ont répondu à cette question (taux de réponse 100 %).
Les audits sur place se sont concentrés sur les éléments organisationnels des « trajets de prédialyse ». Nous avons constaté que dans 20/24 hôpitaux, il s’agissait de séances d’information organisées individuellement, généralement données par un ou plusieurs infirmiers (spécifiques). En outre, les services sociaux ou d’accompagnement des patients, un diététicien, un psychologue et un néphrologue sont souvent impliqués (dans cet ordre). Une seule fois, un chirurgien vasculaire, un coordinateur de soins rénaux et un expert du vécu ont également été mentionnés. Les séances d’information étaient destinées au patient et à toutes les personnes concernées (principalement les proches et les aidants proches, mais les infirmiers à domicile, les interprètes, les infirmiers et le personnel de cuisine des centres de soins résidentiels (CSR) ont également été mentionnés). Le trajet a été consulté et/ou présenté aux associations ou cercles de médecins généralistes dans 16/24 centres et consulté et/ou présenté aux patients et/ou associations de patients dans 8/24 centres. Les diététiciens eux-mêmes ont dit être impliqués dans le trajet de prédialyse dans 12/24 centres.
Constatation : Dans 8 centres sur 10, la politique en matière de soins était largement conforme aux données scientifiques en la matière. Outre le déploiement généralisé d’un trajet de prédialyse multidisciplinaire, une attention supplémentaire doit être accordée à une formation validée de tout le personnel infirmier et des autres prestataires de soins (en tout cas, au niveau de ceux qui fournissent les explications). Une attention particulière doit être accordée à l’éducation la plus personnalisée possible et surtout à l’accompagnement. “All staff, irrespective of their role, need to be trained about all treatment options so that informal conversations with patients are not biased. The study argues for a more individualised approach to Patient Dialysis Education (PDE) which is more like counselling than education and would demand a higher level of skill and training for specialist PDE staff.” (Combes, Sein, et Allen 2017). Un élément important ici, est aussi l’effet sur l’observance thérapeutique : “Patient education improves health and treatment adherence of patients with chronic kidney disease. However, evidence about the sufficiency of patients’ knowledge processed in patient education is limited. Hence, attention should be paid to supporting patients with more personalized knowledge” (Inkeroinen et al. 2021).
5.1.2 Une ou plusieurs échelles validées sont-elles utilisées pour évaluer correctement les comorbidités, la qualité de vie et la fonctionnalité des patients âgés de plus de 70 ans ? (EL)
Motivation (KPI) : “Het goed in kaart brengen van de comorbiditeit, kwaliteit van leven en functionaliteit van patiënten boven de 70 jaar bij chronische nierschade stadium 4 en 5, bij voorkeur met gevalideerde schalen, is nodig”, volgens de Nederlandse richtlijnen (« Nierfunctievervangende behandeling » 2024). À cet effet, les néphrologues et les gériatres ont déjà pris des initiatives communes au niveau européen (ERA-EDTA) : ” The population of patients with moderate and severe CKD is growing. Frail and older patients comprise an increasing proportion…. In 2013 the advisory board of ERBP initiated, in collaboration with the European Union of Geriatric Medicine Societies (EUGMS), the development of a guideline on the management of older patients with CKD stage 3b or higher.” (Farrington et al. 2017).
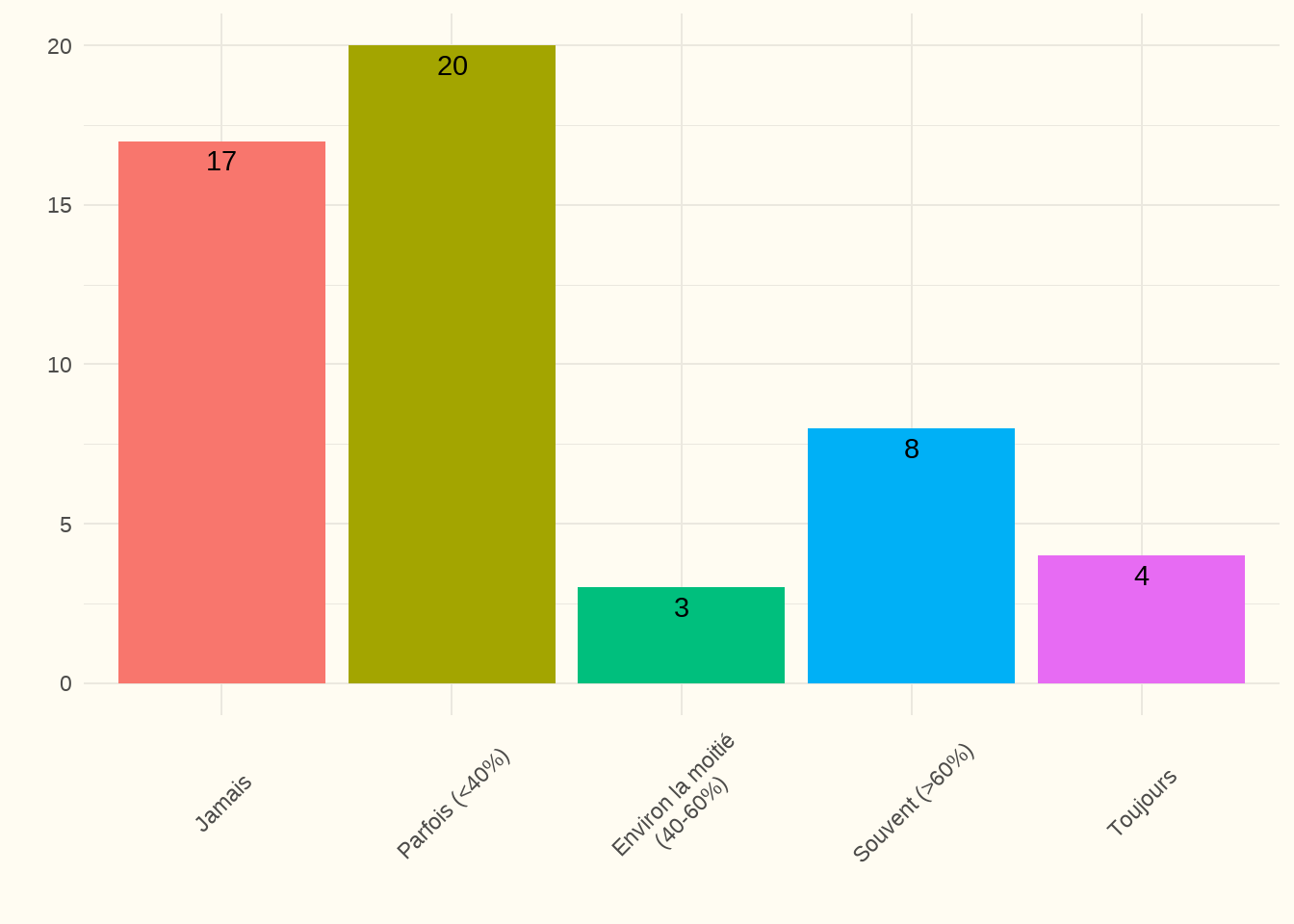
Constatation : Dans 71 % des centres, ces échelles ont été utilisées « parfois » ou « jamais ». Seuls 8 % des centres les utilisent de façon systématique. 67 % des répondants ont répondu à la question relative aux échelles utilisées. Parmi celles-ci, le Mini-Mental State Examination (62 %), l’échelle de Katz (60 %) et la Clinical Frailty Scale (Score de fragilité clinique) (46 %) ont été citées, et 37 % des répondants ont (également) mentionné d’autres échelles.
Les audits sur place ont également examiné plus en détail ce que contenaient effectivement les dossiers des patients. Dans 10/24 centres, une échelle complétée a pu être trouvée.
Discussion : Une approche spécifique du patient âgé ne doit pas nécessairement être réalisée en collaboration avec le gériatre ou par le gériatre, mais il convient d’utiliser des outils de dépistage développés et validés spécifiquement pour la population gériatrique. “We propose a risk stratification algorithm in which all patients at high risk of early death are offered an early multidisciplinary approach that includes a comprehensive assessment to organize supportive care for patients and their families, and ethics advice if needed. Patients with intermediate risk may be referred for comprehensive assessment to outpatient geriatric services but could also be seen by mobile geriatric units that may intervene in dialysis units or at home. For patients at lower risk, nephrologists and nurses should receive training in the use of the various geriatric screening tools, such as G8 in oncogeriatry… including comorbidity, malnutrition, functional disability, and the absence of reliable social support”. (C. G. Couchoud et al. 2015). Étant donné que seule une minorité de centres l’ont fait de manière systématique, il reste encore du chemin à parcourir. Par contre, il est positif de constater que plusieurs centres ont très récemment commencé à utiliser une échelle d’évaluation validée.
5.2 Plan de soins
5.2.1 Un score validé est-il utilisé pour estimer le pronostic des patients avant le début du traitement de dialyse ? (EL)
Motivation (PHOTO) : Étant donné qu’un plan de soins nécessite un certain horizon temporel, il est nécessaire de pouvoir se faire une image étayée du pronostic à court terme (en utilisant, p. ex. le score (a)REIN basé sur la comorbidité et l’âge) (Peeters et al. 2016). Cela, dans le but suivant : “This simple clinical score effectively predicts short-term prognosis among elderly patients starting dialysis. It should help to illuminate clinical decision making, but cannot be used to withhold dialysis. It ought to only be used by nephrologists to facilitate the discussion with the patients and their families” (C. Couchoud et al. 2009).
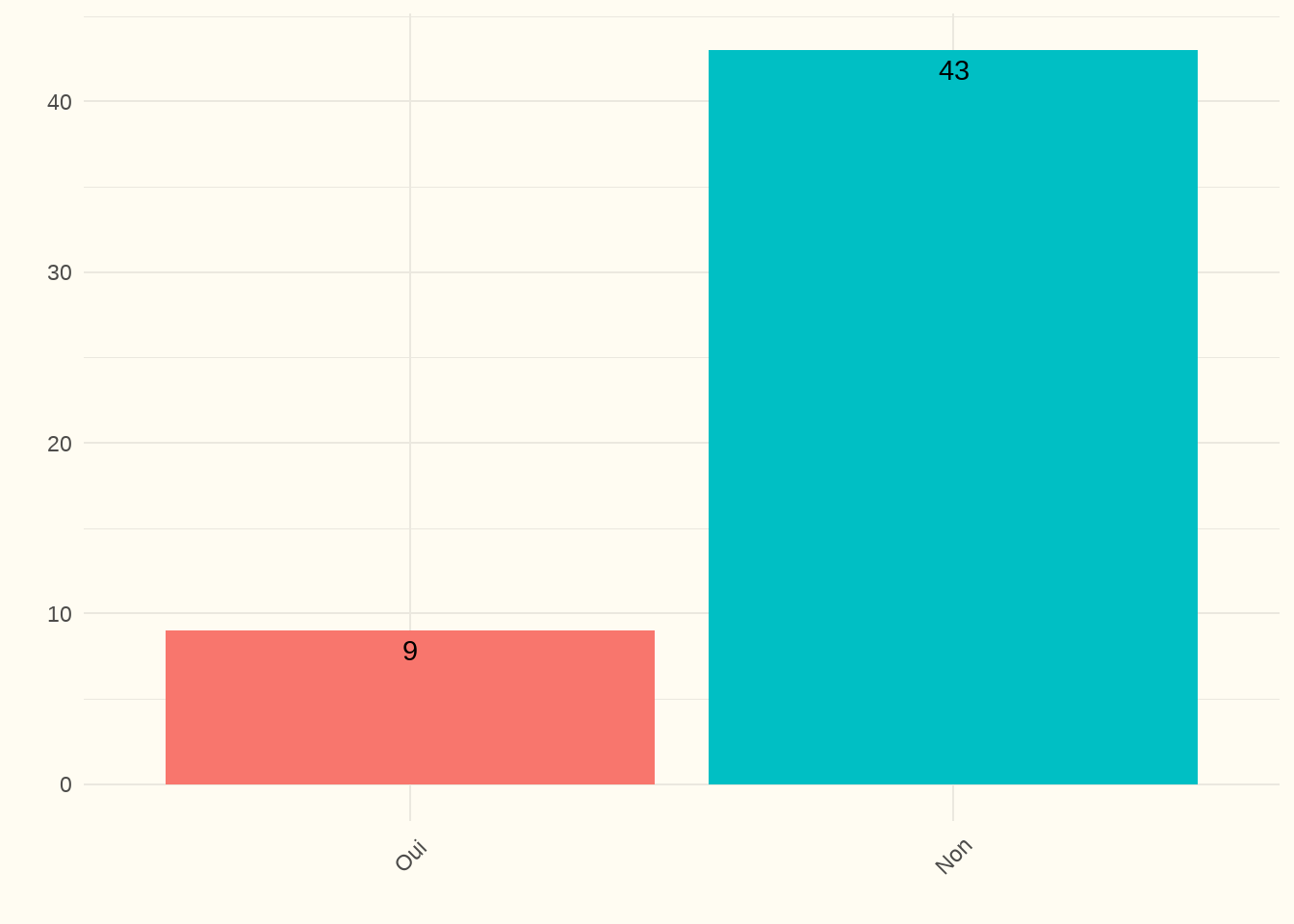
Constatation : 82 % des centres ont déclaré ne pas utiliser d’outil pour estimer le pronostic. Le taux de réponse a été de 100 %. Sur les 9 centres qui l’ont estimé, tous ont utilisé le score pronostique Rein.
Les audits sur place ont également examiné plus en détail ce que contenaient effectivement les dossiers des patients. Nous avons constaté que, dans seulement 3/24 centres, on a pu trouver un score pronostique complété. Certains centres ont très récemment commencé en utiliser mais aucun score de ce type complété n’a encore été trouvé.
Constatation : il est souhaitable de poursuivre le déploiement du score (a)REIN. Il convient néanmoins de tenir compte, dans ce cadre, du fait que ce score n’a été validé que pour des personnes âgées de plus de 75 ans (C. Couchoud et al. 2009)
Remarque du panel d’experts : Il convient de souligner que les échelles utilisées ne doivent jamais servir de critères de décision, mais qu’il s’agit plutôt d’outils de communication dans le contexte d’une prise de décision partagée.
5.2.2 Une planification anticipée des soins (advanced care planning) est-elle effectuée pour les patients de plus de 70 ans et enregistrée dans le dossier électronique du patient (DEP) ? (EL)
Motivation (PHOTO) : “Tous les patients atteints d’insuffisance rénale terminale et traités par hémodialyse ont besoin d’un plan de soins mis à jour annuellement qui comprend : a) une approche à court terme sur 1 à 2 ans et un plan sur 5 ans et b) une approche sur les besoins d’accès avec 3 composantes (création d’un accès, plan d’urgence, plan de suivi).” (Lok e.a. 2020). Cela s’applique plus particulièrement aux patients gériatriques. Goto (2018) déclare ainsi: “Les troubles gériatriques sont fréquents dans la population IRCT âgée. Étant donné que les limitations peuvent être négligées lorsqu’elles ne sont pas recherchées dans le cadre des soins réguliers de (pré)dialyse, la première étape dans l’amélioration des soins néphrologiques est la prise de conscience de l’étendue des troubles gériatriques ”.
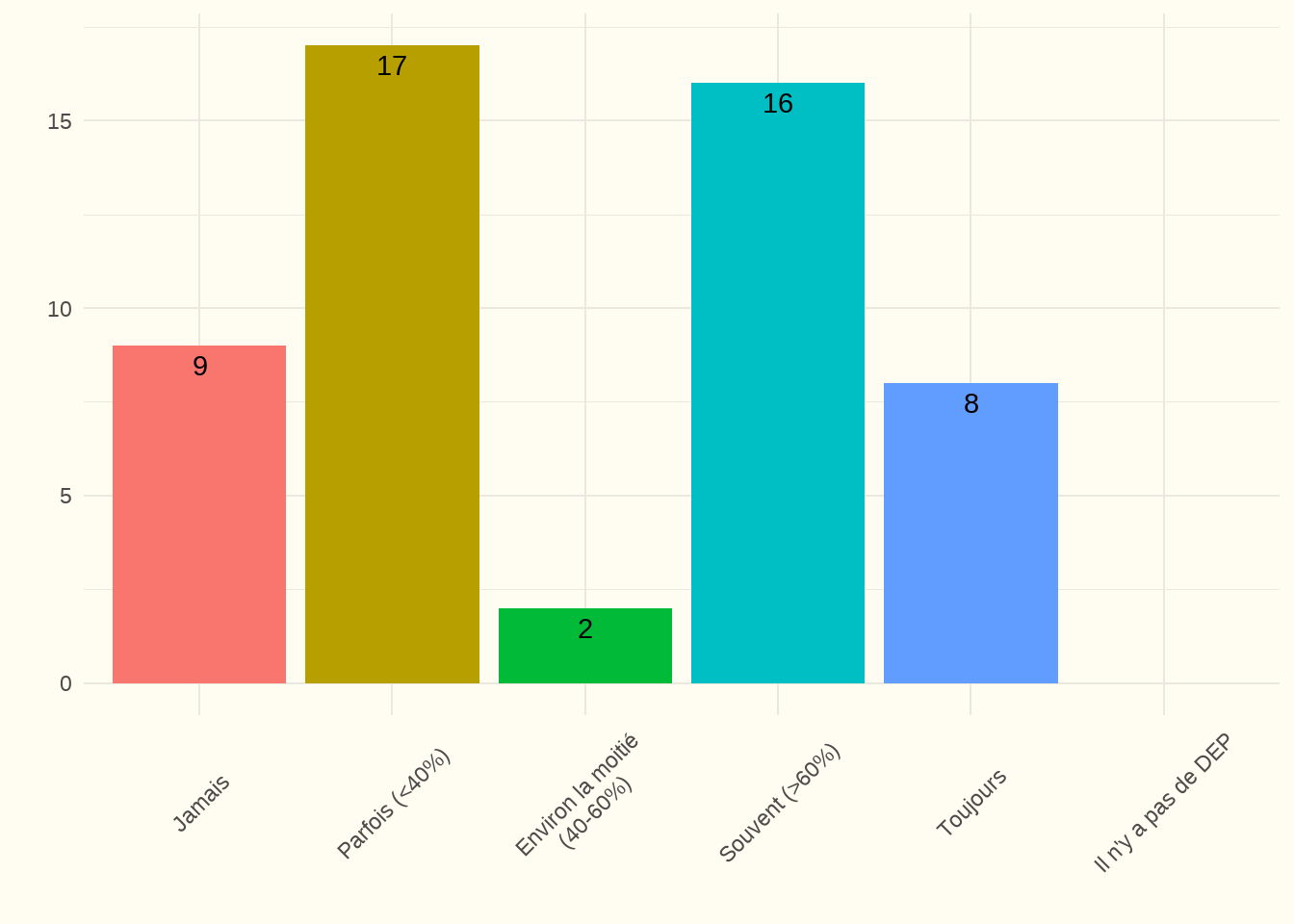
Constatation : La moitié des centres ont indiqué qu’une Advanced Care Planning (ACP) ) est « parfois » ou « jamais » réalisée et enregistrée dans le DEP des patients âgés de plus de 70 ans. Le taux de réponse a été de 100 %.
Nous avons également sondé les interrogés sur la participation des patients et/ou des aidants proches à la rédaction ou à l’adaptation de cette ACP. La majorité des centres ont indiqué que la participation était « fréquente » (25 %) ou « systématique » (47 %). Concernant cette participation, 16 % d’entre eux ont répondu « jamais ». Un centre n’a pas répondu à cette question.
Discussion : Il est encore possible d’améliorer et de généraliser la mise en œuvre d’un plan de soins (ACP). Dans la mesure du possible, la participation du patient ou de l’aidant proche doit être possible. Le nouveau numéro de nomenclature « 103994 » est entré en vigueur le 1/7/2024. Cet AR (24/4/2024) exige ce qui suit : “un rapport de la mise au point néphrologique ainsi qu’une proposition de plan de soins pluridisciplinaires personnalisé avec entre autres un plan alimentaire, une planification anticipée des soins et une thérapie de substitution rénale (si une forme de thérapie de substitution rénale n’est pas possible, il faut préciser pourquoi cette forme n’est définitivement ou provisoirement pas possible). Ce rapport est transmis au médecin généraliste et conservé dans le dossier électronique du patient ” La rédaction de ces courriers doit s’inscrire dans le cadre d’une collaboration avec les médecins généralistes autour des patients dialysés, faute de quoi une large proportion d’entre elles n’aura que peu voire pas de valeur ajoutée pour le patient (par exemple, parce qu’il n’est pas suivi par un médecin généraliste).
5.2.3 Pour les patients dialysés âgés de plus de 70 ans, un code DNR (do not resuscitate) est-il enregistré dans le dossier électronique du patient (DEP) ? (EL)
Motivation (KPI) : “Patients clearly need enhanced education with respect to end-of-life care issues. Most patients in this study prefer care focused on decreasing pain and suffering; only 18% of patients preferred clinical care that focuses on extending life, even if at the expense of prolonging pain and discomfort” (Davison 2010). Dans ce cadre, il ne faut pas oublier les éléments suivants : “Cessation of life-support treatment is an appropriate option for situations in which the burdens of therapy substantially outweigh the benefits. Decisions to withdraw dialysis now precede 1 in 4 deaths of patients who have end-stage renal disease.” (Cohen, Germain, et Poppel 2003).
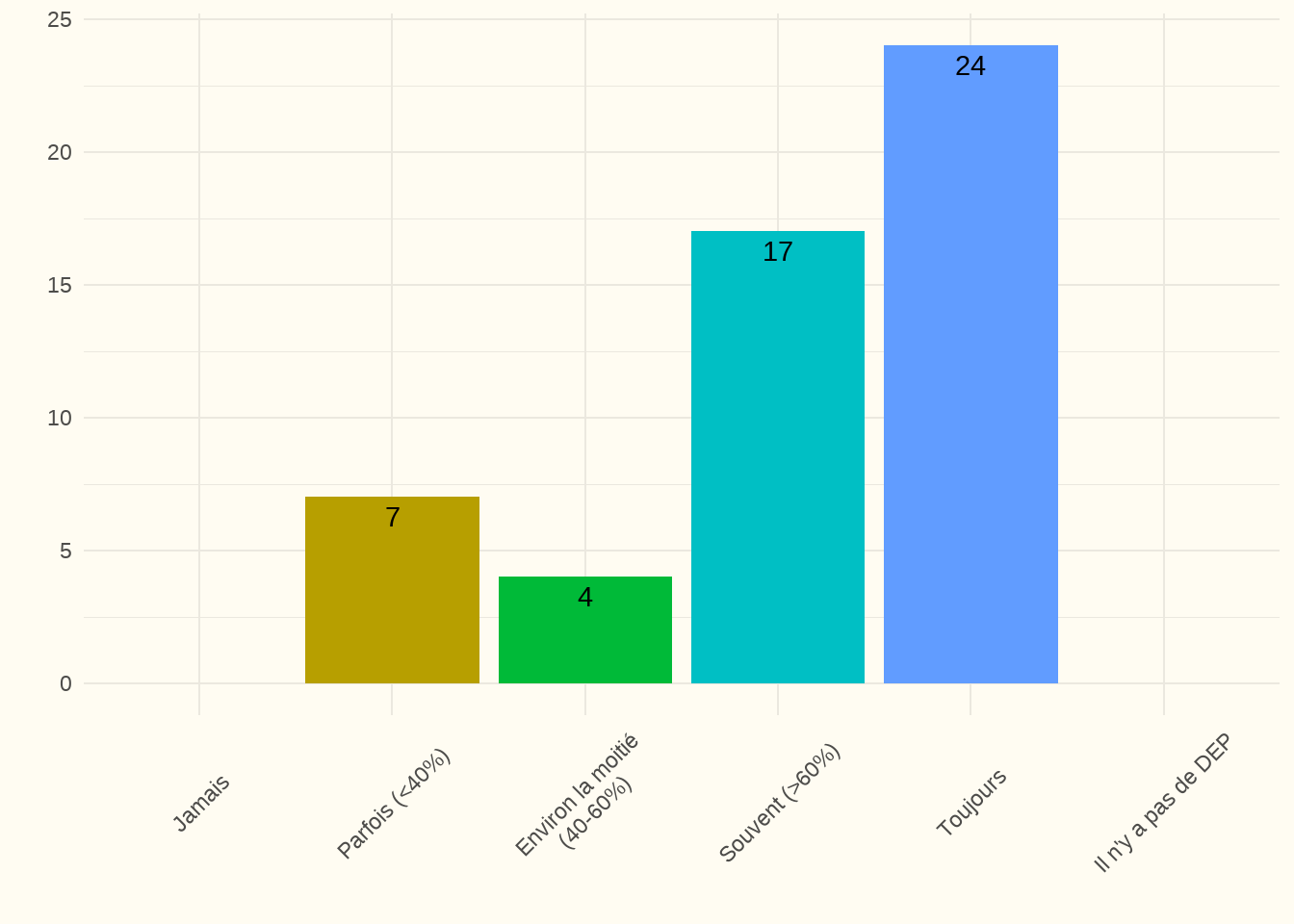
Constatation : La majorité des centres ont indiqué qu’un code DNR était « souvent » (33 %) ou « toujours » (46 %) enregistré. Un autre résultat important à cet égard est que tous les hôpitaux ont indiqué qu’ils disposaient effectivement d’un DEP. Il est très important, en effet, que tous les prestataires de soins de l’hôpital puissent immédiatement voir le statut DNR en cas de problème urgent. Le taux de réponse a été de 100 %.
Les audits sur place ont également examiné plus en détail ce que contenaient effectivement les dossiers des patients. Nous avons constaté que dans 19/24 centres, tous les médecins et infirmiers interrogés pouvaient montrer les scores DNR complétés chez les patients de plus de 70 ans. Dans trois centres, le score DNR n’était pas enregistré !
Discussion : L’enquête en ligne a montré que la majorité des centres déclarent (le plus souvent) déterminer les codes DNR pour cette population plus âgée et plus vulnérable. L’audit sur place l’a confirmé. Un nombre limité d’hôpitaux doit encore être fortement sensibilisé à ce niveau !