| n | Qualification code | Description NL | Description FR |
|---|---|---|---|
| 8284 | 140 | arts-specialist in de heelkunde | médecin spécialiste en chirurgie |
| 1 | 170 | arts-specialist in de neurochirurgie | médecin spécialiste en neurochirurgie |
| 1 | 340 | arts-specialist in de gynaecologie en verloskunde | médecin spécialiste en gynécologie-obstétrique |
| 1 | 370 | arts-specialist in de oftalmologie | médecin spécialiste en ophtalmologie |
6 Hémodialyse
L’hémodialyse dans un centre de dialyse agréé ou l’hémodialyse dans un CAD sont les formes de traitement de l’insuffisance rénale chronique terminale les plus couramment utilisées dans notre pays.
6.1 Voie d’accès
Motivation (KPI) : Dans la directive KDOQI (mise à jour 2019) on peut lire que : “La mortalité était significativement plus faible avec une fistule artério-veineuse (FAV) ou une greffe artério-veineuse (GAV) qu’avec un cathéter veineux central (CVC) chez les patients de moins de 80 ans, mais ce lien n’était pas présent chez les patients âgés de 80 ans ou plus ” (Lok et al. 2020).
Cette directive recommande (statements 2.3 à 2.6) de donner la préférence un accès artério-veineux (fistule ou greffe) plutôt qu’à un CVC. S’il faut néanmoins commencer par un CVC, il y est suggéré de passer ensuite, si possible, à une FAV ou à une GAV. Cela, afin d’éviter les risques d’infection et les hospitalisations liées à des infections ainsi que d’autres complications (statement 2.6) (Lok et al. 2020). À cet égard, les pratiques montrent de grandes différences selon les pays (Pisoni et al. 2021).
6.1.1 Qui crée la voie d’accès ?
6.1.1.1 La fistule AV comme voie d’accès
L’aperçu ci-dessous montre quelles sont les disciplines principalement impliquées (top 5) dans la création d’une fistule AV en tant que voie d’accès.
Constatation : Comme on pouvait s’y attendre, il s’agit presque exclusivement de médecins spécialistes en chirurgie. Pratiquement toutes les disciplines ont cependant été çà et là citées (même un ophtalmologue).
6.1.1.2 Le cathéter veineux central (CVC) comme voie d’accès
Dans l’aperçu ci-dessous, nous montrons quelles disciplines sont principalement (top 5) impliquées dans la pose d’un CVC permanent (type Hickman, Tesio, …) comme voie d’accès pour l’hémodialyse.
| n | Qualification code | Description NL | Description FR |
|---|---|---|---|
| 5248 | 140 | arts-specialist in de heelkunde | médecin spécialiste en chirurgie |
| 1404 | 930 | arts-specialist in de röntgendiagnose | médecin spécialiste en radiodiagnostic |
| 76 | 100 | arts-specialist in de anesthesie-reanimatie | médecin spécialiste en anesthésiologie - réanimation |
| 17 | 580 | arts-specialist in de inwendige geneeskunde | médecin spécialiste en médecine interne |
| 16 | 900 | arts-specialist in de urgentiegeneeskunde | médecin spécialiste en médecine d’urgence |
Constatation : Comme on pouvait également s’y attendre, il s’agit surtout de médecins spécialistes en chirurgie. Nous avons également vu une proportion importante de radiologues et, dans une moindre mesure, d’intensivistes/urgentistes.
6.2 Pose d’une fistule AV avant le début de la dialyse ?
Pour donner un premier aperçu, le graphique en entonnoir ci-dessous montre, sur l’axe Y, le rapport entre le nombre de fistules AV nouvellement posées pour le début de l’hémodialyse et le nombre total de patients hémodialysés. L’axe des X indique le nombre de patients en HD par centre avec une première dialyse au cours de la période d’observation du 1/7/2017 au 1/7/2021, cela, afin de nous permettre d’avoir des informations sur les 6 mois avant et après la mise en place des fistules AV.
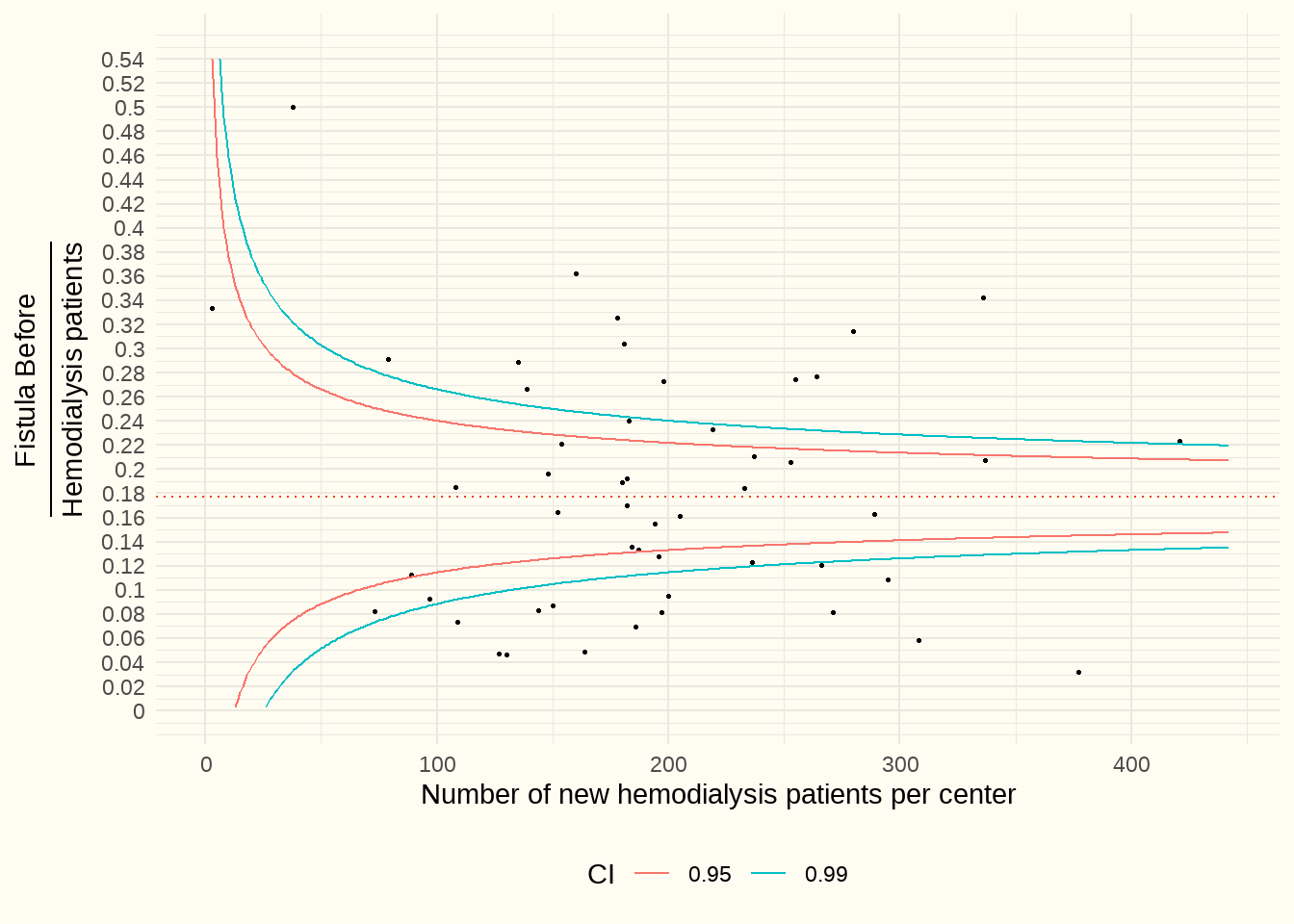
Constatation : La médiane est de 17%. Le tableau que nous obtenons est très hétérogène. Dans un seul centre, la fistule AV est posée avant le début de l’hémodialyse dans > 50 % des cas mais pour plusieurs centres ce pourcentage reste inférieur à 10 %.
Discussion : Le « modèle idéal » est un hôpital qui pose des fistules AV, en temps opportun avant le début de la dialyse chez tous les patients chez lesquels c’est possible. Plusieurs raisons (parfois des contre-indications) peuvent toutefois justifier d’opter pour un CVC. C’est notamment le cas face à une crise aiguë imprévue ou si l’espérance de vie est inférieure à 12 mois. Il convient de noter à ce sujet que les contre-indications à la pose d’une fistule AV peuvent considérablement varier d’un clinicien à l’autre (Dumaine et al. 2018; Marsh, Genova, et Buicko Lopez 2025).
Pour éviter le problème des contre-indications, le graphique en entonnoir ci-dessous a été créé. Il s’agit du rapport entre les fistules AV posées avant le début de l’hémodialyse et l’ensemble des fistules posées (axe Y). Ceci, en fonction du nombre de patients en HD dans le centre (axe X).
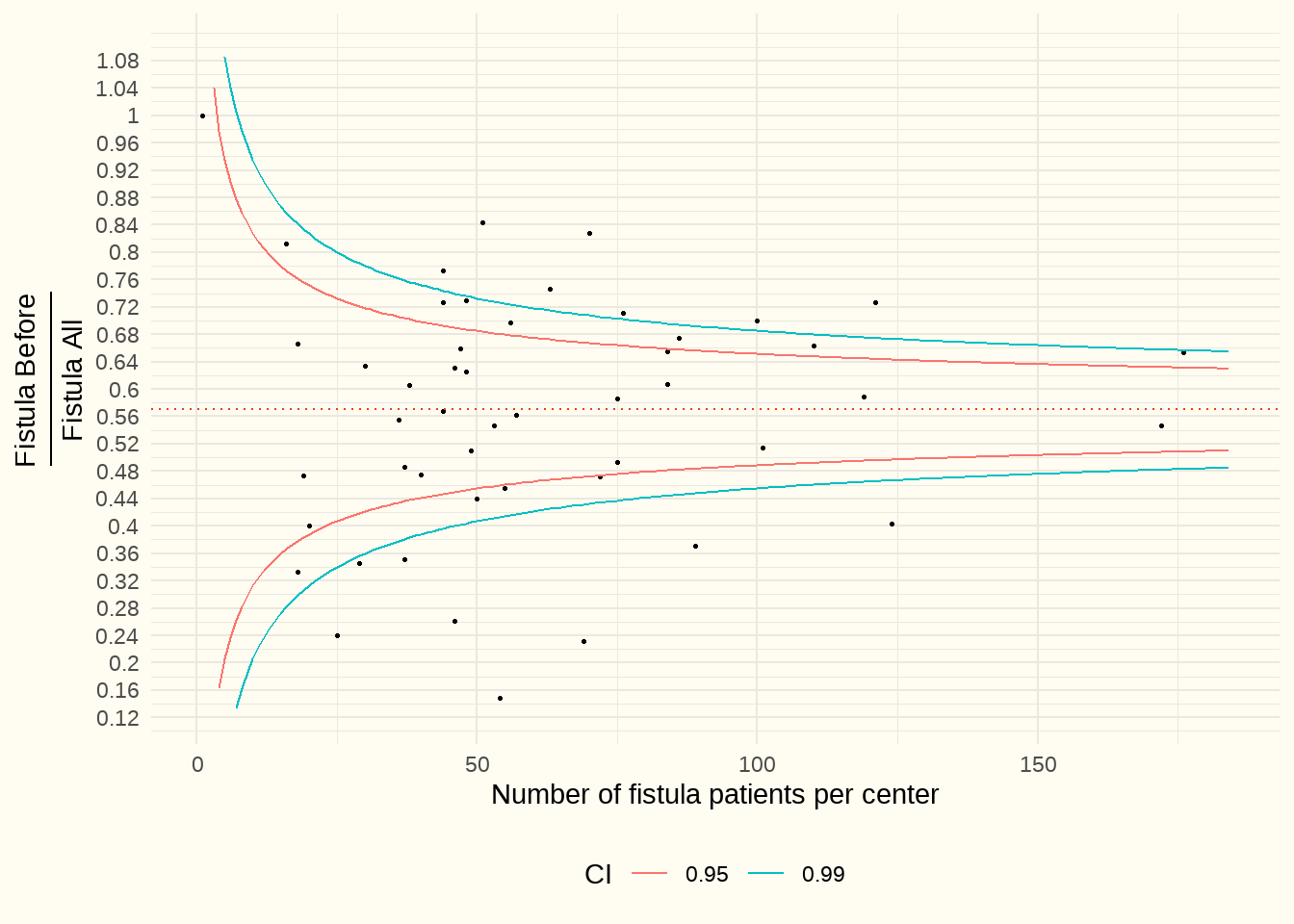
Constatation : La médiane est de 57%. Ici aussi, le tableau est très hétérogène ; certains centres posent jusqu’à plus de 75 % de leurs fistules AV avant le début de la dialyse, tandis que d’autres restent en deçà de 25 %.
Si un patient entre en ligne de compte pour la pose d’une fistule AV, les directives indiquent qu’il est important qu’elle soit posée avant le début de la dialyse. L’évaluation comparative individuelle (voir les rapports individuels) permet aux hôpitaux de voir s’ils peuvent améliorer leurs résultats et de quelle manière.
Commentaire du panel d’experts : le principe « fistula first » est sujet à discussion et il est proposé d’évoluer vers un plan de traitement personnalisé (ESKD Life Plan). Il faut également veiller à éviter la pose (trop) précoce de fistules AV chez des patients (âgés) qui finissent par ne jamais être utilisés. “In 2019, the management of end-stage kidney disease (ESKD) shifted away from”Fistula First” (FF) to “ESKD Life-Plan: Patient Life-Plan First then Access Needs.” Indeed, some patients exhibit such excessive comorbidity that even relatively minor vascular surgery may be complicated.” (Ghandour et al. 2024).
6.3 Complications liées à la voie d’accès
Dans les figures suivantes, nous allons vous donner un aperçu des complications qui ont été codées dans l’ICD10-BE comme un « diagnostic d’admission vérifié ». C’est sur cette base que nous avons sélectionné nos audits sur place. Ces audits ont montré que tous les codes utilisés correspondaient effectivement à des problèmes liés à la dialyse qui avaient conduit à une hospitalisation. Les figures n’illustrent donc pas le nombre total de complications, mais uniquement celles qui ont conduit à une hospitalisation.
6.3.1 Les complications infectieuses
Le graphique en entonnoir ci-dessous (Figure 6.3) montre, par centre (axe X), le rapport entre le nombre de séjours hospitaliers dus à des infections liées à la voie d’accès1 et le nombre de patients en HD dans ce centre (axe Y). Afin de mélanger le moins possible les patients en hémodialyse et en dialyse péritonéale, les patients chez lesquels on a posé un cathéter de DP pendant la période d’observation n’ont pas été repris dans cette analyse. Nous avons utilisé les données du doc P pour la période d’observation 1/1/2017-31/12/2021. Les patients admis dans plusieurs centres ont été pris en compte dans chaque centre.
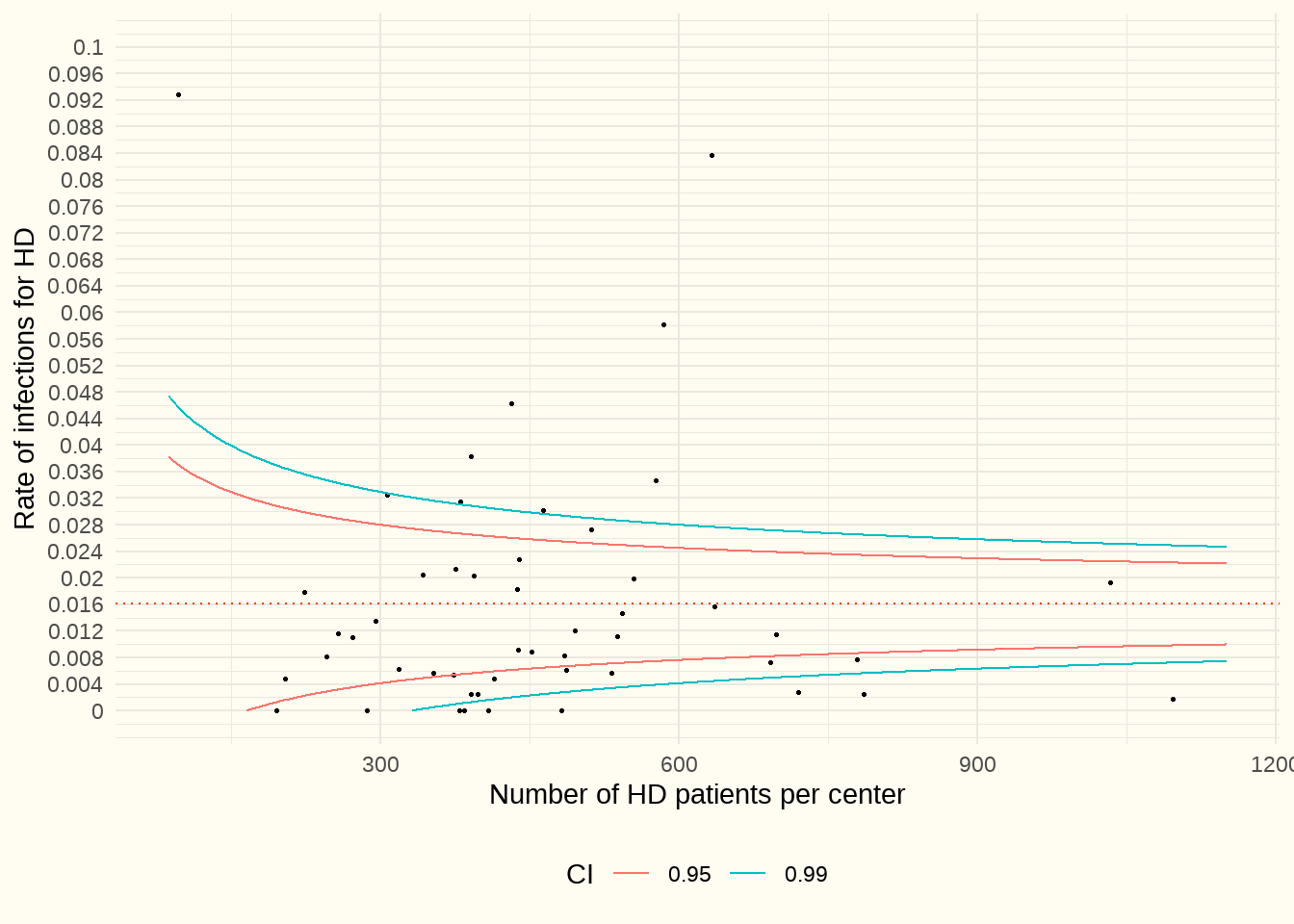
Constatation : La médiane est de 1.1%. Nous constatons des différences significatives entre les centres. Au niveau des aberrances positives (en dessous de la ligne bleue de l’IC à 0,99) il n’y a (pratiquement) pas eu d’hospitalisations en raison d’infections liées au cathéter. Six centres n’ont pas enregistré d’infections. Les centres situés au-dessus de la ligne bleue supérieure de l’IC à 0,99 ont eu beaucoup plus d’infections que la moyenne pondérée (aberrances négatives).
Discussion : Les différences pourraient être en partie dues à la mesure dans laquelle les infections sont traitées principalement sur une base ambulatoire ou principalement par le biais d’une hospitalisation dans un centre. Lors des audits sur place, nous avons constaté que les centres ne menaient pas une politique uniforme en la matière. L’évaluation comparative individuelle (cf. les rapports individuels) permet aux hôpitaux de voir s’ils peuvent améliorer leurs résultats et de quelle manière.
Commentaire du panel d’experts : dans les études scientifiques, le nombre des CRBSI par 1000 jours cathéters est utilisé à des fins de comparaison. Ce chiffre n’a pas pu être calculé à partir des données administratives.
6.3.2 Les complications mécaniques
Les complications mécaniques ont été réparties dans les deux diagrammes en entonnoir suivants, dans lesquels le rapport entre les séjours dus à des complications mécaniques liées à la voie d’accès et le nombre de patients en HD dans le centre (axe Y) est tracé en fonction de la taille du centre (via les codes de pseudonomenclature HD) (axe X).
6.3.2.1 Fistules AV
Il s’agit des dysfonctionnements, déplacements, fuites,… des fistules avec les codes ICD10BE suivants : T82.510, T82.511, T82.520, T85.521, T82.530, T82.531, T82.590, T82.591. Afin de mélanger le moins possible les patients en hémodialyse et en dialyse péritonéale, les patients chez lesquels on a posé un cathéter de DP pendant la période d’observation n’ont pas été repris dans cette analyse. La période couverte allait du 1/1/2017 au 31/12/2021. Les patients admis dans plusieurs centres ont été pris en compte dans chaque centre.
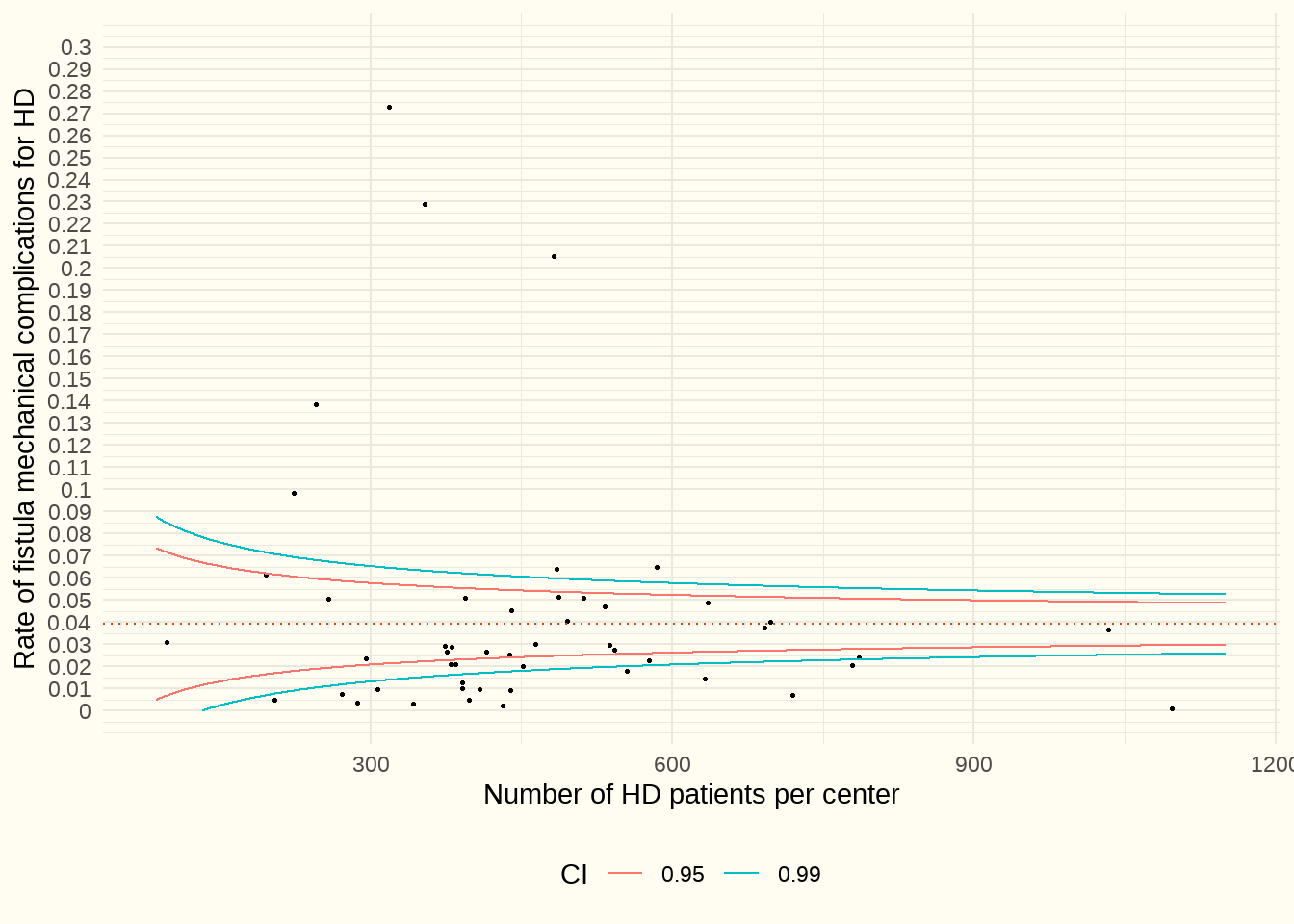
Constatation : La médiane est de 2.7%. Au niveau des aberrances négatives, le nombre de complications mécaniques au niveau des fistules pouvait aller jusqu’à 0,25 (25 %). Aucun centre n’a été épargné par les complications.
6.3.2.2 CVC
Il s’agit des dysfonctionnements, déplacements, fuites, … au niveau des CVC (codes ICD10-BE T82.41 à T82.43, T82.49). Afin de mélanger le moins possible les patients en hémodialyse et en dialyse péritonéale, les patients chez lesquels on a posé un cathéter de DP pendant la période d’observation n’ont pas été repris dans cette analyse. La période couverte allait du 1/1/2017 au 31/12/2021.
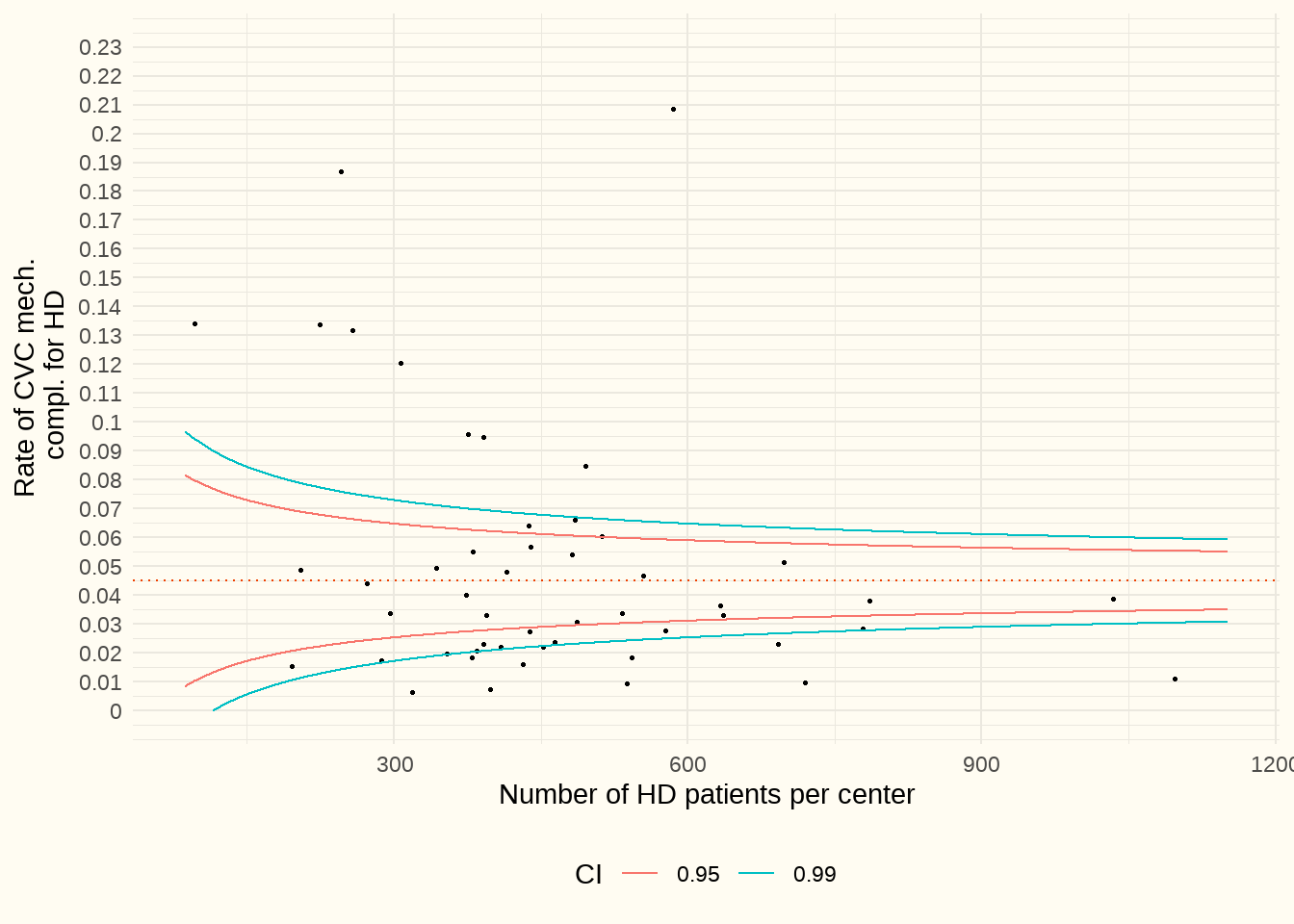
Constatation : La médiane est de 3.5%. Au niveau des aberrances négatives, le nombre de complications liées au CVC pouvait aller jusqu’à 0,215 (215 %). Aucun centre n’a été épargné par les complications.
Discussion : Il est possible que certains hôpitaux (de troisième ligne) aient accueilli de nombreux patients souffrant de complications mécaniques, envoyés par d’autres hôpitaux et que cela ait eu un impact négatif sur leurs chiffres. Par conséquent, l’objectif de ces évaluations comparatives est que l’hôpital les utilise à des fins d’autoréflexion et, que si un résultat inférieur aux valeurs de référence ne peut pas être expliqué, il prenne les mesures d’amélioration qui s’imposent.
Commentaire du panel d’experts : dans les études scientifiques, le nombre des complications mécaniques par 1000 jours-cathéters est utilisé à des fins de comparaison. Ce chiffre n’a toutefois pas pu être calculé à partir des données administratives.
6.4 Infections
“Catheter-related infections (CRI) are a major cause of morbidity and mortality in chronic hemodialysis (HD) patients”. (Hajji et al. 2022). Pour le nombre des infections liées aux CVC par centre, veuillez vous référer au Section 6.3.1.
6.4.1 Évolution des infections et des germes responsables
Motivation (PHOTO) : “End stage renal disease (ESRD) patients on renal replacement therapy (RRT) have an increased risk of morbidity and mortality due to healthcare associated infections (HCAIs). The burden of HCAIs among the patients undergoing RRT is high. Preventive strategies and optimum empirical therapy of antibiotics should be used to reduce the risk of these infections among ESRD patients.” (Abbasi et al. 2023; Farrington et Allon 2019b).
Le tableau ci-dessous donne un aperçu des germes cultivés (principalement) chez les patients hémodialysés admis en hôpital de jour ou en hospitalisation classique en raison d’une septicémie et/ou d’une CRBSI. Ces codes ne sont pas spécifiquement liés à la dialyse et il s’agit donc d’un indicateur « proxy ». Pour mélanger le moins possible ces patients et les patients PD, les patients chez lesquels on a placé un cathéter PD pendant la période d’observation ont été exclus. Comme pour tous les chiffres, il s’agit uniquement des données des 52 centres de dialyse agréés. Si nous calculons ce chiffre pour tous les hôpitaux, nous obtenons un total général de 596 et une prévalence de 7825 pour 2021.
| code_diagnose_desc_en_short | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Sepsis due to streptococcus, group A | 7 | 4 | 5 | 4 | 0 |
| Sepsis due to streptococcus, group B | 10 | 7 | 7 | 7 | 10 |
| Sepsis due to Streptococcus pneumoniae | 14 | 14 | 27 | 7 | 4 |
| Other streptococcal sepsis | 14 | 20 | 16 | 13 | 15 |
| Streptococcal sepsis, unspecified | 5 | 0 | 2 | 0 | 0 |
| Sepsis due to Methicillin susceptible Staphylococcus aureus | 81 | 91 | 86 | 73 | 66 |
| Sepsis due to Methicillin resistant Staphylococcus aureus | 11 | 12 | 15 | 6 | 8 |
| Sepsis due to other specified staphylococcus | 18 | 36 | 32 | 15 | 25 |
| Sepsis due to unspecified staphylococcus | 4 | 1 | 2 | 1 | 1 |
| Sepsis due to Hemophilus influenzae | 5 | 3 | 2 | 0 | 0 |
| Sepsis due to anaerobes | 5 | 3 | 10 | 10 | 3 |
| Gram-negative sepsis, unspecified | 7 | 2 | 4 | 4 | 6 |
| Sepsis due to Escherichia coli [E. coli] | 128 | 126 | 127 | 118 | 87 |
| Sepsis due to Pseudomonas | 12 | 11 | 11 | 15 | 7 |
| Other Gram-negative sepsis | 35 | 37 | 39 | 37 | 49 |
| Sepsis due to Enterococcus | 28 | 30 | 48 | 32 | 37 |
| Other specified sepsis | 25 | 34 | 29 | 20 | 15 |
| Sepsis, unspecified organism | 138 | 123 | 104 | 73 | 73 |
| Actinomycotic sepsis | 1 | 0 | 1 | 0 | 0 |
| Bloodstream infection due to central venous catheter, init | 56 | 62 | 62 | 95 | 104 |
| Grand Total | 604 | 616 | 629 | 530 | 510 |
| Prevalence HD patients | 6762 | 6891 | 6995 | 7264 | 7400 |
Constatation : les germes les plus fréquemment codés sont « sepsis E. Coli à E. Coli » (avec une tendance à la baisse) et « sepsis à Methicillin susceptible Stapylococcus aureus » (avec une tendance à la baisse). Le nombre de septicémies sans étiologie a également diminué de manière significative : « sepsis t.g.v. unspecified organism ». Si on considère plus spécifiquement les CRBSI (« bloodstream infection due to CVC »), ce nombre augmente clairement, passant de 56 en 2017 à 104 en 2021. Cependant, le nombre total de séjours hospitaliers liés à des infections chez les patients hémodialysés a fortement diminué (-15.56%) passant de 604 en 2017 à 510 en 2021, et encore plus fortement baissé par rapport au nombre de patients en HD (de 8.9% à 6.9%).
Discussion : En 2021, sur un total de 510 patients hémodialysés admis pour une septicémie ou une CRBSI, 73 (14.5%) présentaient un “unspecified organism” in 2021. Cela correspond à ce que Farrington mentionne : “Une suspicion de CRBSI est confirmée chez 85% des patients hémodialysés qui ont un cathéter. (Farrington et Allon 2019a). Selon la directive KDOQI, « pour les cathéters veineux centraux (à ballonnet ou pas, tunnelisés ou pas, CVC final ou pas), l’objectif à atteindre est le suivant : <1,5 bactériémie liée au cathéter par 1 000 jours-cathéters ». (Lok et al. 2020). Il n’a cependant pas été possible de calculer le nombre de CRBSI/1000 jours-cathéters à partir de nos données administratives. Dans l’idéal, les hôpitaux calculent eux-mêmes cette valeur à partir de leurs propres registres de complications (voir plus loin Section 10.2).
6.4.2 Ajustements des antibiotiques
Motivation (PHOTO) : “After blood cultures have been obtained from a patient with suspected CRBSI, initial therapy should include broad spectrum antibiotic coverage until blood culture growth and sensitivities are available. A relatively short (2–3 week) course of tailored systemic antibiotics with an adjuvant antibiotic catheter lock is reasonable in uncomplicated CRBSI. A longer (6–8 week) course of tailored antibiotic therapy with catheter removal or exchange is more appropriate in patients with complicated CRBSI”. (Farrington et Allon 2019b).
Le traitement initial (en aveugle) et le traitement de suivi des séjours hospitaliers classiques avec un diagnostic d’admission vérifié de septicémie ou de « catheter related bloodstreaminfection » (CRBSI) ont été analysés pour les patients admis (principalement) en hémodialyse. Les 4 ajustements possibles entre les antibiotiques à spectre large et les antibiotiques à spectre étroit sont présentés dans le tableau ci-dessous pour la période du 1/1/2017 au 31/12/2021.
| Switch | n |
|---|---|
| broad -> broad | 926 |
| broad -> narrow | 866 |
| narrow -> broad | 711 |
| narrow -> narrow | 564 |
Constatation : On est surtout passé d’un large spectre à un large spectre. Dans une minorité de cas, un AB à spectre étroit instauré initialement a été remplacé par une autre AB à spectre étroit.
Discussion : Le démarrage se fait majoritairement avec un AB à large spectre, ce qui est en accord avec la recommandation citée tirée de l’article de Farrington (2019b).
Nous avons également examiné dans quelle mesure un antibiogramme avait été réalisé. Au cours des années 2017-2021, 3569 séjours ont fait l’objet d’un diagnostic d’admission vérifié de septicémie ou de CRBSI. Dans ce cadre, sur la base de nos données administratives, un antibiogramme a été effectué dans 3305 cas (93 %). Le nombre d’hémocultures positives n’a pas pu être vérifié à partir des données administratives.
Lors de l’audit sur place, il a été vérifié, au niveau des dossiers, si des hémocultures avaient été réalisées chez les patients admis pour suspicion de CRBSI /de septicémie et si un antibiogramme avait été réalisé chez ces patients en cas de culture positive. Sur les 48 cas avec hémocultures positives, dans 41 cas (85 %) l’antibiogramme a pu être montré et dans 39 cas les antibiotiques ont été ajustés en conséquence.
6.5 Antibiotiques les plus couramment utilisés en cas de CRBSI et/ou de septicémie
Le tableau ci-dessous présente les 10 antibiotiques (types d’antibiotiques) les plus couramment utilisés lors de séjours hospitaliers classiques chez les patients (principalement) hémodialysés avec « sepsis » ou « CRBSI » comme diagnostic d’admission vérifié dans l’ICD10BE. Ce chiffre est basé sur les données SHA pour la période 2017-2021.
| dénomination | n |
|---|---|
| glycopeptide | 664 |
| céphalosporine de 3ème génération | 581 |
| inhibiteurs de β lactamases utilisés en association avec une β lactamine | 476 |
| pénicilline sulfone | 428 |
| aminoside | 414 |
| Fluoroquinolone | 373 |
| céphalosporine de 1ère génération | 337 |
| céphalosporine de 3ème génération = association avec avibactam | 335 |
| pénicilline G | 280 |
| pénicilline M | 260 |
Constatation : Les 2 antibiotiques les plus couramment utilisés sont les glycopeptides (comme la vancomycine) et les céphalosporines de troisième génération (comme la ceftazidim ou la ceftriaxone).
L’audit sur place a cherché à savoir si une antibiothérapie initiale standardisée était décrite dans un protocole (dans le cadre des soins de la voie d’accès) et si elle était connue dans le service. C’était effectivement le cas dans 10/24 centres. Cette approche a fait l’objet d’une concertation avec un hygiéniste hospitalier et/ou un infectiologue et/ou le comité d’hygiène hospitalière dans 10/24 centres.
Constatation : Le top 2 (vancomycine et ceftazidim) est repris dans l’arbre de décision tel que décrit par Farrington. Nous n’avons pas pu vérifier ses recommandations en matière d’utilisation d’un cathéter avec verrou d’antibiotiques (Farrington et Allon 2019b). Il convient de recommander d’élaborer et de rédiger une politique antibiotique commune pour chaque centre de dialyse afin d’assurer une plus grande standardisation et de réduire le risque d’erreur au niveau des soins infirmiers et de la pharmacie. Pour cela, le mieux est de se concerter au niveau de l’(du comité d’)hygiène hospitalière.
Commentaire du panel d’experts : dans le choix du traitement, il est important de tenir compte des aspects liés au confort du patient, à la pharmacocinétique des antibiotiques et à la possibilité (ou non) d’utiliser des perfusions périphériques. On peut, par exemple, donner 4 fois 1g de Floxapen IV pendant l’hospitalisation ou 2g de céfazoline IV à la fin de la dialyse pour que le patient puisse rentrer chez lui.
6.6 Suivi en laboratoire
Motivation (PHOTO) : Le suivi en laboratoire des patients dialysés est variable. Thomas affirme ainsi : “Surveillance blood work is routinely performed in maintenance hemodialysis (HD) recipients. Although more frequent blood testing may confer better outcomes, there is little evidence to support any particular monitoring interval. Monthly routine blood testing in HD recipients was not associated with a lower risk for death, cardiovascular events, or hospitalizations as compared with testing every 6 weeks. Given the health resource implications, the frequency of routine blood sampling in HD recipients deserves careful reassessment.” (Thomas et al. 2020).
6.6.1 Fonction rénale (DFGe) au début de la dialyse
Motivation (PHOTO) : Dans le contexte des comparaisons, y compris avec d’autres pays, le moment d’instauration du traitement de substitution rénale est important. La fonction rénale peut être estimée par le « débit de filtration glomérulaire estimé » (DFGe). La prévalence de l’insuffisance rénale dépend de la manière dont elle a été diagnostiquée. Par exemple, les taux de prévalence sont différents selon qu’ils sont déterminés sur la base d’un diagnostic ou de valeurs de laboratoire (Sundström et al. 2022).
Pour le calcul du DFGe, le panel d’experts a décidé d’utiliser la formule « CKD EPI 2009 » (« Previous eGFR Calculator for Reference - NIDDK » s. d.). Er werd op nationaal niveau nog steeds geen standaard vastgelegd, terwijl dit reeds een aanbeveling was in het KCE rapport 124 uit 2010. Une norme n’a toujours pas été fixée au niveau national, alors qu’il s’agissait déjà d’une recommandation dans le rapport 124 de 2010 du KCE. Pour les centres flamands, nous avons reçu de la Nederlandstalige Belgische Vereniging voor Nefrologie (NBVN) l’aperçu ci-dessous. Il reprend les patients en HD et PD combinés (N=5907), pour la période du 1/1/2018 au 31/12/2022. Calculé selon la formule CKD EPI 2009 avec exclusion de l’insuffisance rénale aiguë (irréversible) (N=269), des patients présentant un syndrome de dilemme cardio-rénal (N=705) et de l’absence de la créatinine en début de la dialyse (N=140 ; 2,8 %)). Au total, cela concernait encore 4793 patients. Les données ont été ventilées en fonction de la valeur médiane du flux d’entrée (160 patients).
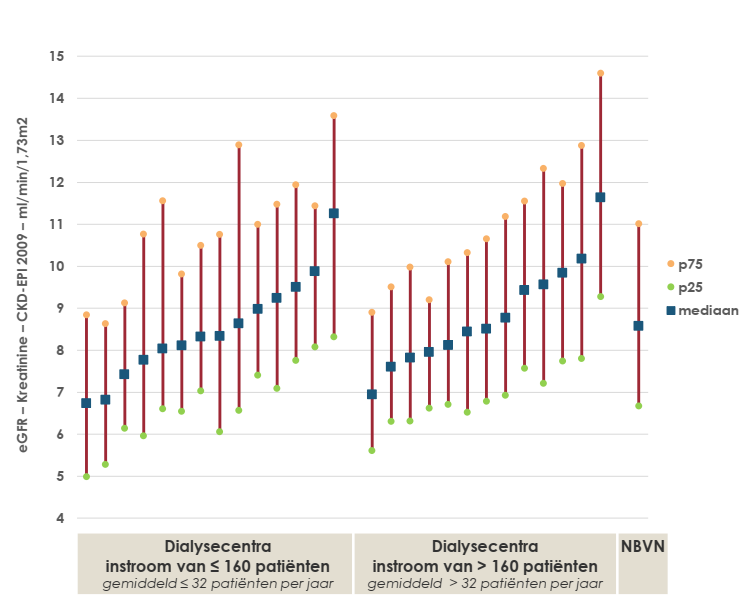
Constatation : au démarrage de la dialyse, tous les centres ont des valeurs inférieures à 15mL/min/1.73 m2. pour la majorité (p75) de leurs valeurs de DFGe.
Un ensemble de données similaires - sur la même période d’observation et avec la même méthode de calcul du DFGe - qui nous a été fourni par le Groupement des Néphrologues Francophones de Belgique (GNFB), a été traité, par analogie, dans le graphique suivant. Pour des raisons de comparabilité, les centres ont été subdivisés sur la base de la même valeur seuil (160 patients) et ici aussi on a retenu la valeur médiane (bleue), la valeur p75 (point rouge) et la valeur p25 (point vert). Il s’agissait au total de 4997 patients. La valeur de la créatinine au début de la dialyse était manquante chez 35 % (2-99 %) en moyenne des patients.
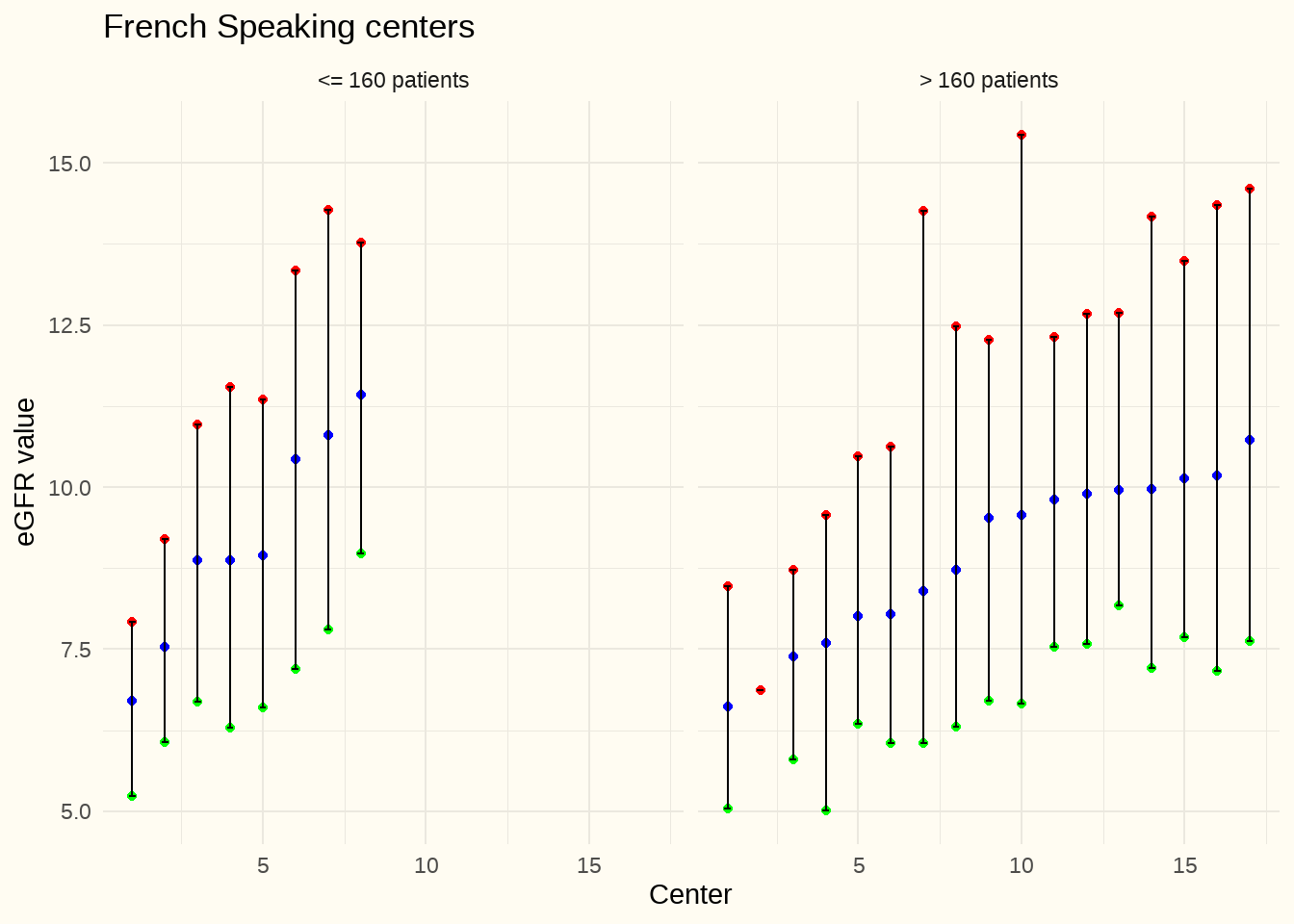
Constatation : à l’exception d’1 centre, tous les centres avaient majoritairement (p75) des valeurs de DFGe inférieures à 15mL/min/1.73 m2. au démarrage de la dialyse.
Discussion : La majorité des valeurs de DFGe au démarrage de la dialyse sont donc conformes à la catégorie de DFG G5 de la directive KDIGO (insuffisance rénale). Cette catégorie est définie comme un DFG inférieur à 15mL/min/1,73 m2 (Stevens et al. 2024). La prévalence de l’insuffisance rénale chronique (IRC) varie en fonction de la manière dont l’insuffisance rénale est déterminée ; “Across 11 countries, 2,4 million Possible CKD patients were identified… In countries with available background population estimates, the prevalence of Possible CKD (a CKD diagnosis or one pathological UACR or eGFR value) was 10,0%.” Pour la Belgique, cela représentait 12 % (voir tableau ci-dessous). . “The prevalence of Measured CKD (two pathological UACR2 or eGFR values at least 90 days apart) was 7,0%, of which one in three were defined by UACR and two in three were defined by eGFR”. Pour la Belgique, cela représentait 5,6 % (Sundström et al. 2022).
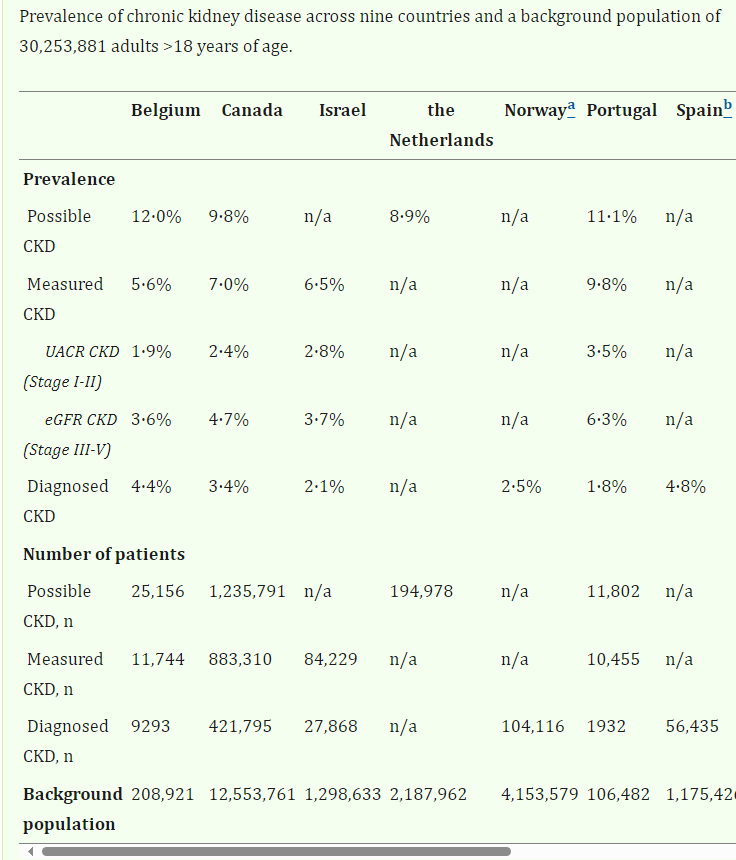
Parmi tous les pays qui disposaient de données sur ce point, c’est en Belgique que la différence de prévalence entre « possible CKD » et « measured CKD » a été la plus importante.
6.6.2 Quelle(s) mesure(s) avez-vous mise(s) en place pour contrôler l’adéquation de l’hémodialyse ? (EL)
Motivation (KPI) : La méthode la plus couramment utilisée pour mesurer l’adéquation de l’hémodialyse (HD), basée sur la clairance de l’urée, est le Kt/V. Cette mesure a été développée par Gotch et Sargent (1980). “Malgré ses limites, le Kt/V à pool unique est la mesure préférée de l’adéquation de la dose de dialyse dans de nombreux centres. Les directives de traitement américaines, européennes, japonaises et canadiennes recommandent une dose minimale de Kt/V de 1,2 pour les patients dialysés trois fois par semaine ” (AlSahow et al. 2021).
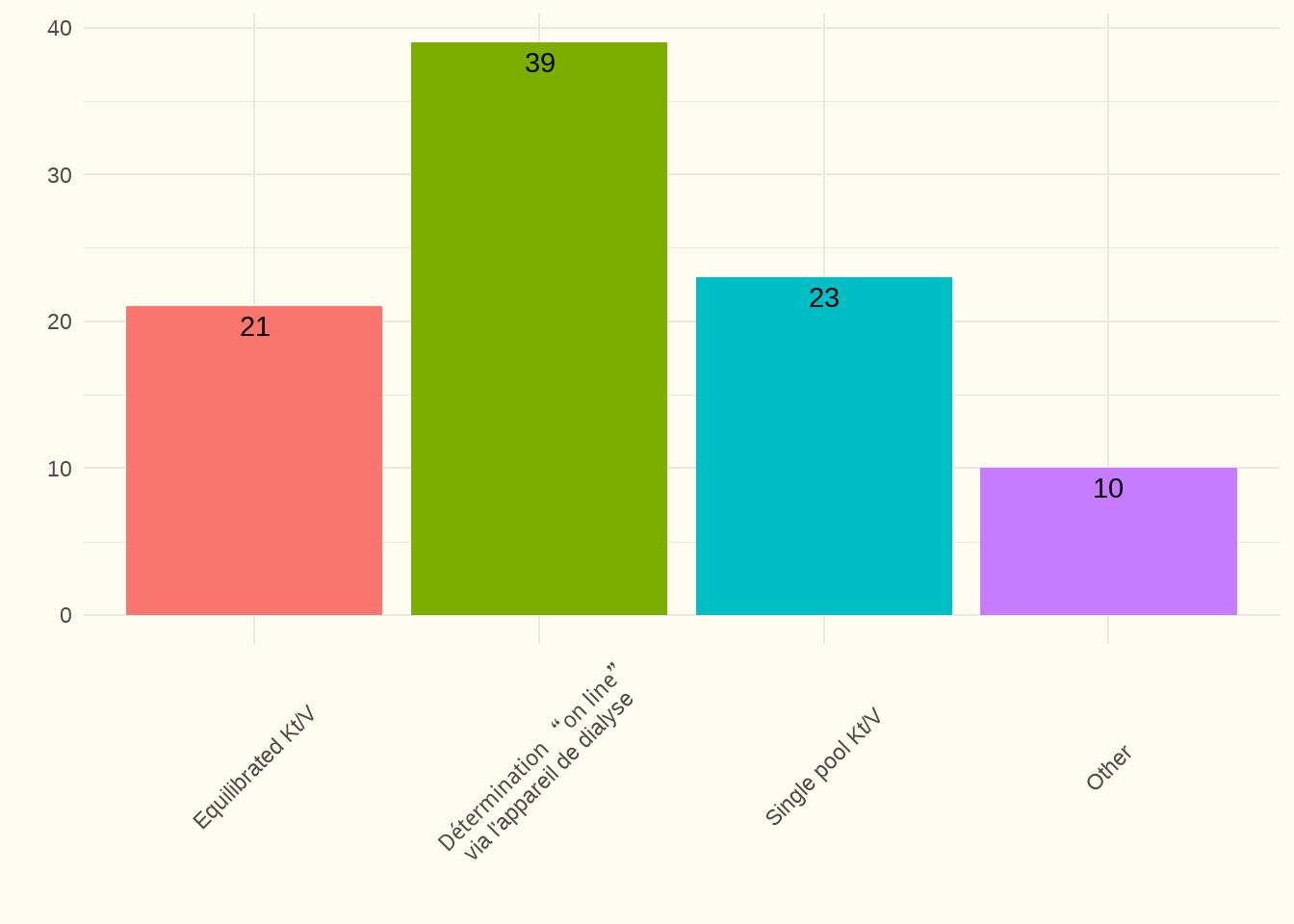
Constatation : La plupart des centres de dialyse ont indiqué qu’il la contrôlait à l’aide (au moins) un « Kt/V équilibré » et/ou pendant chaque séance de dialyse via le dialyseur (« détermination en ligne »). Un seul centre n’a pas répondu à cette question.
Si une mesure du Kt/V a été effectuée sur la base d’une analyse sanguine avec mesure de l’urée avant et après la dialyse, 70 % des centres ont indiqué qu’il le contrôlait de manière systématique. Deux centres n’ont pas répondu à cette question.
Lors de l’audit effectué sur place, les dossiers ont été consultés afin de vérifier si des paramètres et le cas échéant, quels paramètres, avaient été notés dans le cadre du suivi de la dialyse. Ces paramètres ont pu être retrouvés dans 190/216 dossiers. Dans 1 centre, on n’a rien retrouvé. Les paramètres comprennent presque tous le Kt/V (20/24). Dans 19/24 centres, cette détermination a été effectuée à un rythme de 2 à 4 fois par an, tandis que dans un centre, elle l’a été toutes les semaines. Dans un quart des centres visités ces paramètres incluaient (aussi) la clairance de l’urée, clairance de la créatinine et le Kt/V en ligne. Dans un seul centre, les paramètres suivants ont également été mentionnés : test de recirculation, hémodiafiltration (HDF en litres), ultrafiltration, le % du VGM (augmentation de la viscosité du sang), volume sanguin, recherche de caillots et encore les paramètres (complémentaires) suivants : myoglobine, bêta 2 microglobuline, détermination de l’hématocrite, tests de laboratoire mensuels avant et après la dialyse, y compris la détermination de l’hémoglobine (pour évaluer l’administration d’Epo), le taux de catabolisme protidique, dosages du phosphore, du calcium et de l’albumine.
La détermination de la diurèse résiduelle et de la fonction rénale résiduelle a également été examinée. Elle a été documentée dans 113 dossiers. Dans de nombreux cas, le patient présentait déjà une anurie pendant la période étudiée, de sorte que la fonction rénale résiduelle n’était pas applicable. La diurèse résiduelle sur 24 heures (ou 44 heures) a été déterminée presque partout. Un centre ne procédait pas à la détermination de la diurèse résiduelle. Dans un quart des centres visités (6/24), cette mesure a été complétée par la clairance de l’urée ou de la créatinine pour déterminer la fonction rénale résiduelle.
Constatation : Depuis relativement récemment, certains catalyseurs permettent de déterminer le Kt/V « en ligne ». Cette valeur est basée sur le sodium et reflète davantage un « Kt/V équilibré », qui est en moyenne 0,2 plus bas qu’un Kt/V « à pool unique ». La détermination par les dispositifs ne nécessite plus de valeurs de laboratoire pour déterminer l’adéquation (Grzegorzewska et Banachowicz 2006).
Ici, le panel d’experts a fait remarquer que le volume utilisé doit être pris en compte pour calculer correctement le Kt/V, car il peut faire varier la valeur du Kt/V jusqu’à 20 % (Casino et al. 2020). Il a aussi fait remarquer que la manière dont les appareils déterminent le Kt/V en ligne est différente (absorption de l’urée chez Nikisso et Braun, dialyse du sodium chez Fresenius, Nipro, Belco et Baxter). Les limites du Kt/V ont également été soulignées (Raymond Vanhodler, Griet Glorieux, et Sunny Eloot 2015). Enfin, l’importance de ne pas se focaliser uniquement sur le Kt/V a également été soulignée : “Patients and clinicians can have divergent and sometimes conflicting goals for hemodialysis treatment, with clinicians focused on outcomes such as mortality and biochemical markers and patients prioritizing their well-being and lifestyle” (Chan et al. 2019).