| description | # patiënten | # procedures |
|---|---|---|
| Pose du cathéter par ponction (type Tenckhoff) | 42 | 43 |
| Pose d'un cathéter (type Tenckhoff) | 1254 | 1405 |
7 Dialyse péritonéale
Il existe différentes formes de dialyse péritonéale, notamment la dialyse péritonéale continue ambulatoire (DPCA) qui utilise la gravité ou la dialyse péritonéale automatisée (DPA) qui utilise un cycler. Si elles sont appliquées correctement, les deux formes sont équivalentes en termes de survie, de complications les plus courantes et de contrôle du volume (Rabindranath et al. 2007). Le choix peut être déterminé en concertation avec le patient et en fonction de son mode de vie. Étant donné que l’opération requiert une certaine habileté et doit être effectuée dans de bonnes conditions d’hygiène, il est important de disposer de bonnes capacités cognitives et d’un environnement adéquat.
Par rapport à l’hémodialyse, elle présente certains avantages. “Elle favorise l’autonomie du patient, en partie parce qu’il s’agit d’un traitement ambulatoire qui, sous réserve d’un cadre approprié, peut être appliqué dans l’environnement de son choix, par exemple le domicile ou le lieu de travail. La fonction rénale résiduelle se détériorerait moins rapidement et dans la plupart des pays cette solution est plus rentable. En revanche, une utilisation (sous-optimale) peut entraîner des épisodes de péritonite et, à terme, une défaillance technique rendant cette forme de dialyse inutilisable. Elle est également moins adaptée aux patients présentant certaines comorbidités en raison de son effet sur le métabolisme du glucose” (François et Bargman 2014).
7.1 Voie d’accès
Motivation : Selon l’ISPD (2019), les principaux points d’attention sont les suivants : (2019):
Chiffre cible de > 95% de survie du cathéter de DP > 12 mois pour l’approche laparoscopique avancée et > 80% pour les autres méthodes d’insertion.
< 5 % d’infection de la sortie/du tunnel dans les 30 jours suivant le placement.
< 5 % de péritonite dans les 30 jours suivant le placement.
< 1 % de lésions viscérales au moment de l’insertion.
< 1 % de saignement nécessitant une intervention chirurgicale ou une transfusion.
Fuite du cathéter périphérique : valeur de référence par établissement en tant que paramètre d’auto-évaluation.
La plupart de ces mesures ne peuvent pas être calculées de manière fiable à partir de nos données administratives, mais il est essentiel pour leur utilisation que chaque centre de dialyse ait une visibilité sur ce point par le biais d’un registre des complications (voir le chapitre consacré à l’assurance qualité). Cela ne semblait pas être le cas dans tous les centres (voir plus loin sous Section 10.2).
7.1.1 Quelles sont les méthodes de pose d’un cathéter de DP ?
Motivation (PHOTO) : La durée de vie des cathéters de DP est très importante et elle est, en partie, déterminée par son bon placement (Crabtree et al. 2019). Le nombre et la nature des complications évitables varient aussi en fonction de la technique utilisée (Peppelenbosch et al. 2008).
Nous avons d’abord examiné le nombre de procédures facturées. Le Table 7.1 donne un aperçu les cathéters de DP placés au cours des années 2017-2021 (nomenclature 244683, 244672, 470072, 470083).
Constatation : Seul un très petit nombre de cathéters de DP ont été placés par ponction (sous anesthésie locale). La grande majorité d’entre eux ont été placés par laparoscopie ou par chirurgie ouverte. C’est aussi ce qui ressort des réponses données sur les questions concernant la/les techniques(s) utilisée(s) dans notre enquête en ligne :
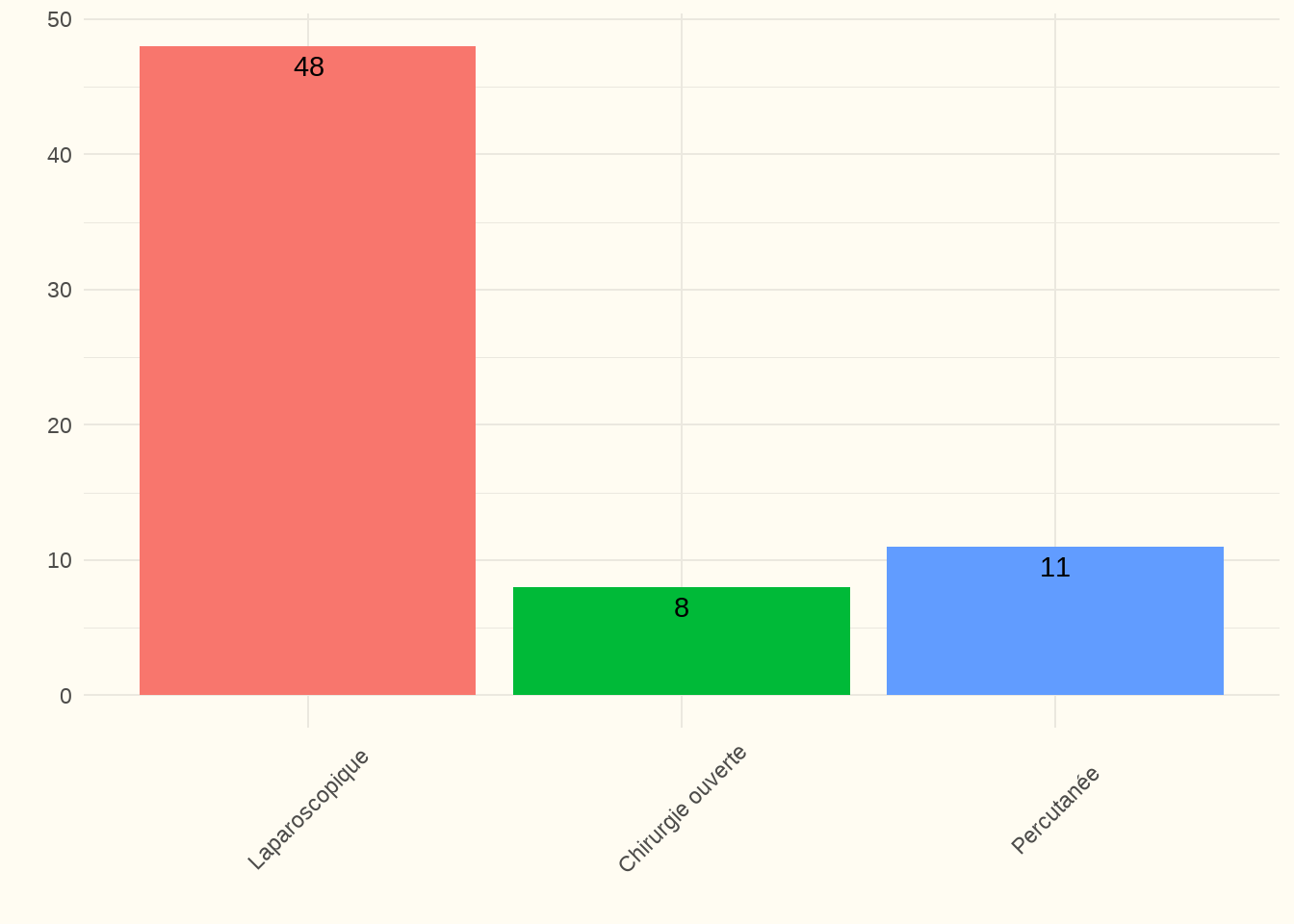
Constatation : 96 % des répondants ont indiqué qu’au niveau de leurs patients, le placement des cathéters de DP se fait (principalement) par laparoscopie. Deux centres n’ont pas répondu à cette question.
Discussion : Le nombre très élevé de cathéters de DP placés par laparoscopie et le très faible nombre de placements par ponction présentent l’avantage suivant : “Despite the similar outcomes of open surgical versus laparoscopic techniques from randomized studies, the laparoscopic insertion has the major advantage of correct catheter positioning in the lower abdomen, with the possibility of adhesiolysis. The minimal invasive percutaneous insertion bears the risk of bowel perforation and catheter malpositioning, and the outcome of this technique is strongly related to the experience of the surgeon.” (Peppelenbosch et al. 2008).
Note du panel d’experts : le faible honoraire du placement à l’aveugle d’un cathéter de DP par ponction influence également les chiffres.
7.1.2 Qui place le cathéter de DP ?
Le tableau ci-dessous montre par quelles disciplines la pose des cathéters PD (type Tenckhoff,…) a été facturée au cours de la période 2017-2021.
| Nombre | Code | Description |
|---|---|---|
| 1402 | 140 | médecin spécialiste en chirurgie |
| 3 | 149 | médecin spécialiste en chirurgie, porteur du titre professionnel particulier en médecine d'urgence |
Constatation : D’après nos données, ils n’ont été facturés, exclusivement, que par des chirurgiens. Dans l’enquête en ligne, nous avons reçu des réponses plus variées à la question de savoir qui plaçait le cathéter.
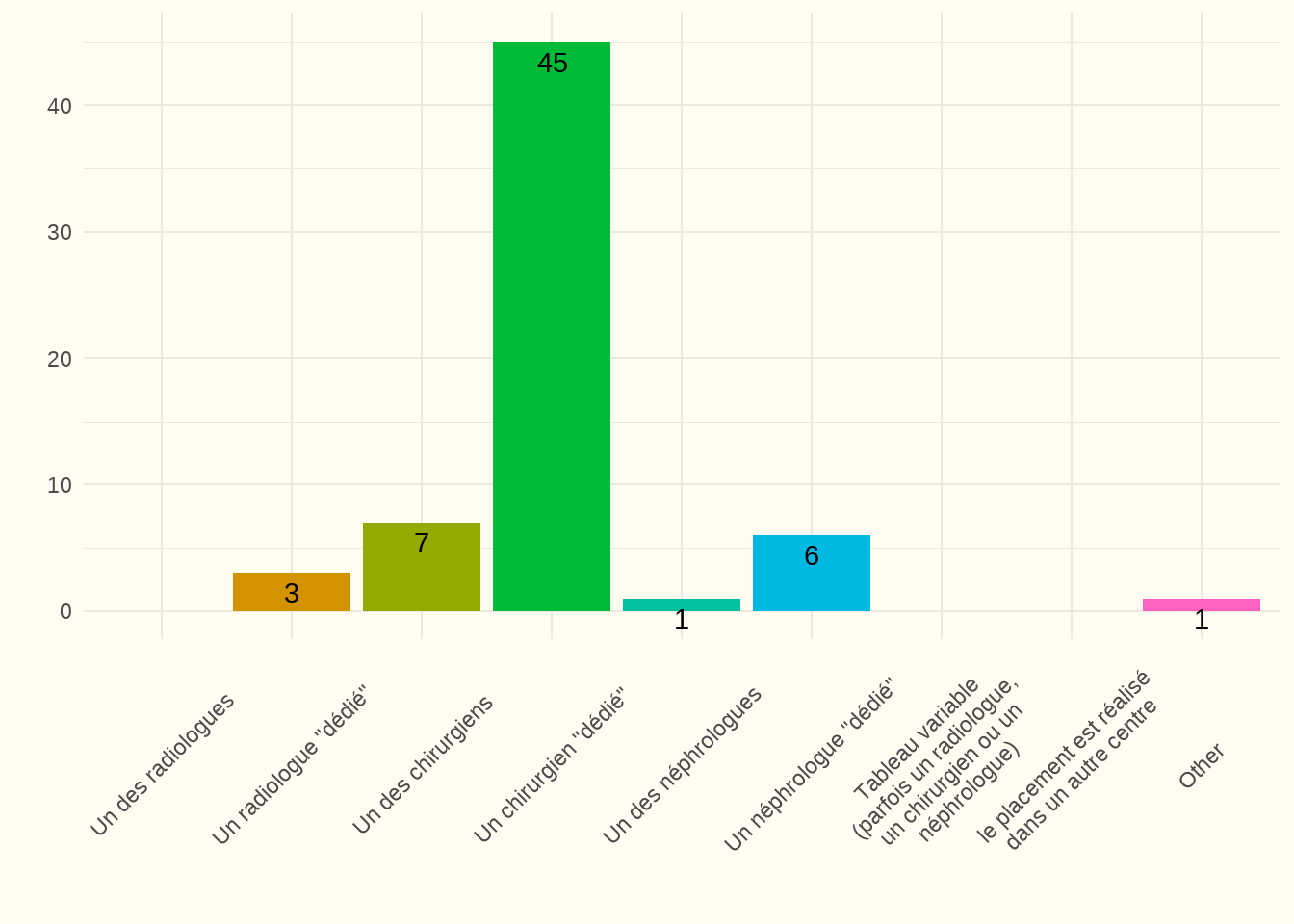
Constatation : 90 % des répondants ont répondu que le placement est effectué par un chirurgien spécifique. Dans 7 centres, il est réalisé (également) par un néphrologue (spécifique ou non spécifique) et dans 3 centres par un radiologue spécifique. Deux centres n’ont pas répondu à cette question. Certains centres confient cette tâche à un chirurgien expérimenté d’un autre hôpital.
Discussion : l’expérience semble être un facteur de réussite important (Peppelenbosch et al. 2008). Par conséquent, le fait que 90 % des répondants aient indiqué que le placement est effectué par un chirurgien spécifique (dédié) est une très bonne chose.
7.1.3 Complications infectieuses liées aux cathéters DP :
Pour les déterminer, nous avons d’abord examiné l’évolution du code ICD10BE T85.71 « infectious/inflammatory reaction due to peritoneal dialysis catheter » sur les années 2017-2021.
| code_diagnose_desc_en_short | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Infect/inflm reaction due to periton dialysis catheter, init | 75 | 94 | 80 | 82 | 64 |
| Infect/inflm reaction due to periton dialysis catheter, subs | 3 | 1 | 4 | 2 | 1 |
| Grand Total | 78 | 95 | 84 | 84 | 65 |
| Data for 2017-2021 | |||||
Constatation : Nous prévoyons un pic au niveau de ces valeurs en 2018 et une tendance plutôt à la baisse par la suite. Comme pour tous les graphiques et tableaux, l’étude s’est limitée aux patients admis dans un hôpital disposant d’un centre de dialyse agréé. Si on inclut tous les hôpitaux, ce chiffre est à peine plus élevé, avec un total général de 67 au lieu de 65 pour 2021.
7.2 Complications infectieuses liées aux cathéters DP (< 30 jours)
Motivation : “Si une infection liée à un cathéter survient dans les 30 jours suivant le placement du cathéter, elle y est associée” (Chow et al. 2023).
La Figure 7.3 présente un graphique en entonnoir. Ce graphique représente la proportion des hospitalisations (de jour et classiques) pour des infections liées à la voie d’accès (code ICD T85.71, septicémie ou péritonite) dans les 30 jours suivant le placement d’un cathéter de DP, par rapport au nombre de cathéters de DP placés (axe Y). L’axe X indique la taille du centre (sur la base du nombre de cathéters de DP placés).
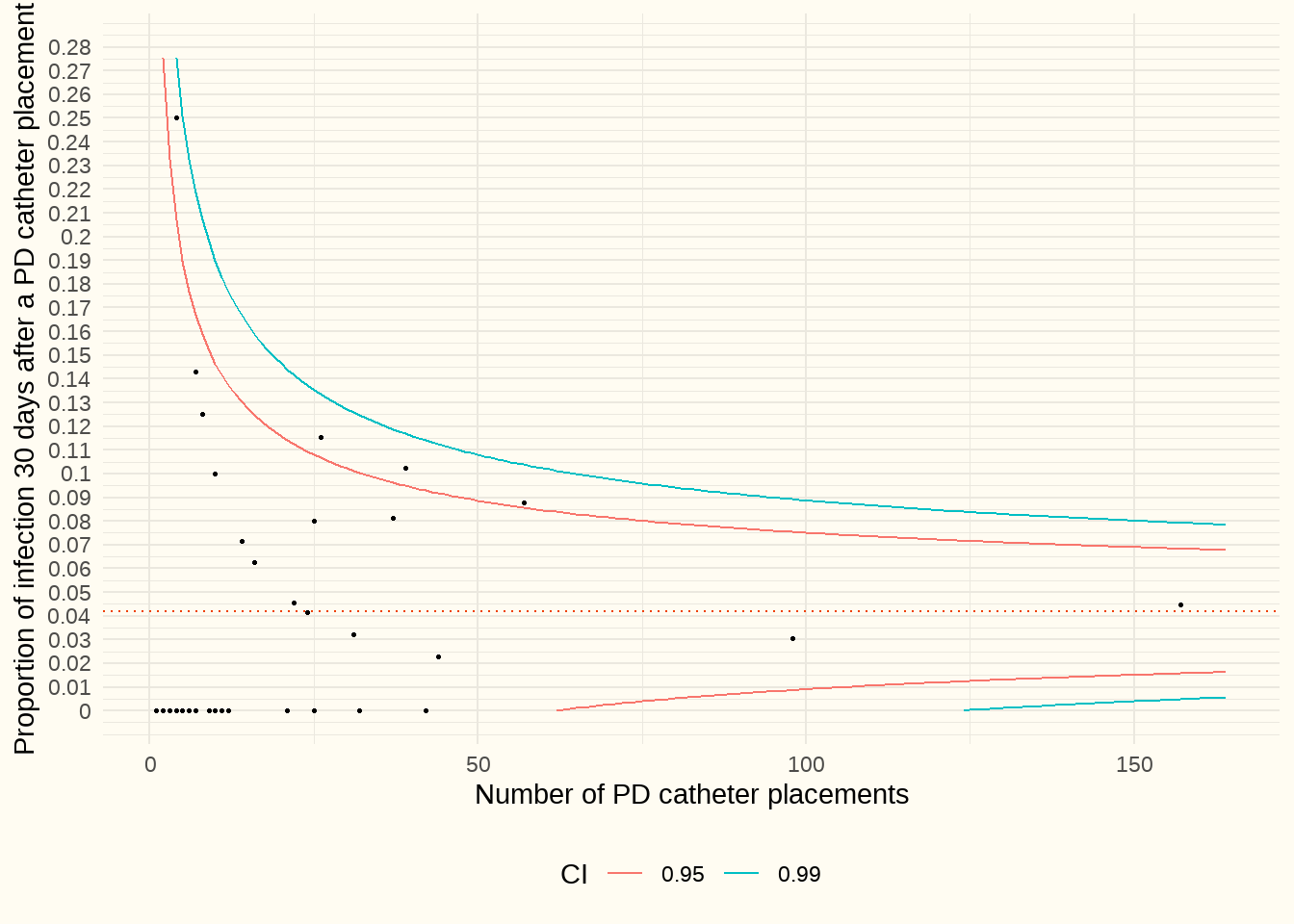
Constatation : La médiane est de 0%. Ce graphique présente 3 aberrances négatives. Pour 1 patient, nous n’avons inclus qu’une seule admission dans les 30 jours, car certains centres travaillent avec des admissions de plusieurs jours et d’autres avec une hospitalisation classique plus longue pour le même épisode infectieux. Le benchmarking individuel permet aux hôpitaux d’éventuellement éviter davantage d’hospitalisations. D’une part, en prévenant les infections et, d’autre part, en mettant en place des politiques de soins qui facilitent au maximum les traitements ambulatoires.
Discussion : Les infections liées aux cathéters peuvent entraîner une augmentation de l’incidence des péritonites, des hospitalisations, des échecs techniques avec transfert en hémodialyse et de la mortalité. En termes de type, les infections peuvent être divisées en infections du site de sortie et en infections du tunnel. Elles peuvent être indépendantes, mais aussi concomitantes. En ce qui concerne l’étiologie, il est important d’identifier un germe causal par le biais d’une culture. Les chiffres cibles utilisés pour les infections du site de sortie sont les suivants : “We recommend that the overall exit site infection rate should be no more than 0.40 episodes per year at risk (2C) and we suggest the proportion of PD catheter insertion-related infection within 30 days of PD catheter insertion should be less than 5% of all catheters inserted (2C)” (Chow et al. 2023).Nous avons constaté que les admissions pour toutes les infections dans les 30 jours étaient généralement inférieures à ces chiffres cibles. Cependant le fait que nous n’ayons pu inclure que les hospitalisations génère un biais considérable et nous ne pouvons pas en tirer de conclusions en termes de politique.
Commentaire du panel d’experts : souvent, le patient n’est pas hospitalisé pour cette raison. Le graphique ci-dessus sous-estime donc largement la réalité.
Les audits sur place ont permis d’examiner les facteurs déterminants ou pas de l’admission d’un patient à l’hôpital pour le traitement d’une infection liée à une DP. La raison la plus fréquente était la situation familiale (autonomie et cadre social (10/24)). La 2e raison par ordre d’importance était le jugement clinique du néphrologue (6/24) ou un patient trop malade (par exemple, hémodynamiquement instable). Des patients qui pouvaient normalement être traités dans le centre de soins résidentiels ont néanmoins été admis en raison d’un cadre de soins infirmiers trop limité ou indisponible essentiel dans ce contexte. Les problèmes liés au contrôle de la douleur et au changement de cathéter en cas d’infection à Staphylococcus aureus ont également été signalés comme motifs d’admission. Dans 4 centres, la DP n’a pas été proposée comme option de traitement ; dans 3 d’entre eux, il y a eu une collaboration avec un autre hôpital pour les patients qui le souhaitaient néanmoins.
7.2.1 Complications mécaniques liées aux cathéters de DP
La figure ci-dessous présente un graphique en entonnoir, qui illustre le ratio entre « les séjours hospitaliers (classique + jour) dus à des complications mécaniques et le nombre patients DP », sur l’axe Y. L’axe X reprend la taille du centre en fonction du nombre de patients en DP (déterminé par des pseudocodes). Les complications mécaniques (y compris les fuites) des cathéters de DP concernaient les codes ICD suivants ; T85.611X, T85.621X, T85.631X et T85.691X et la période 1/1/2017-31/12/2021.
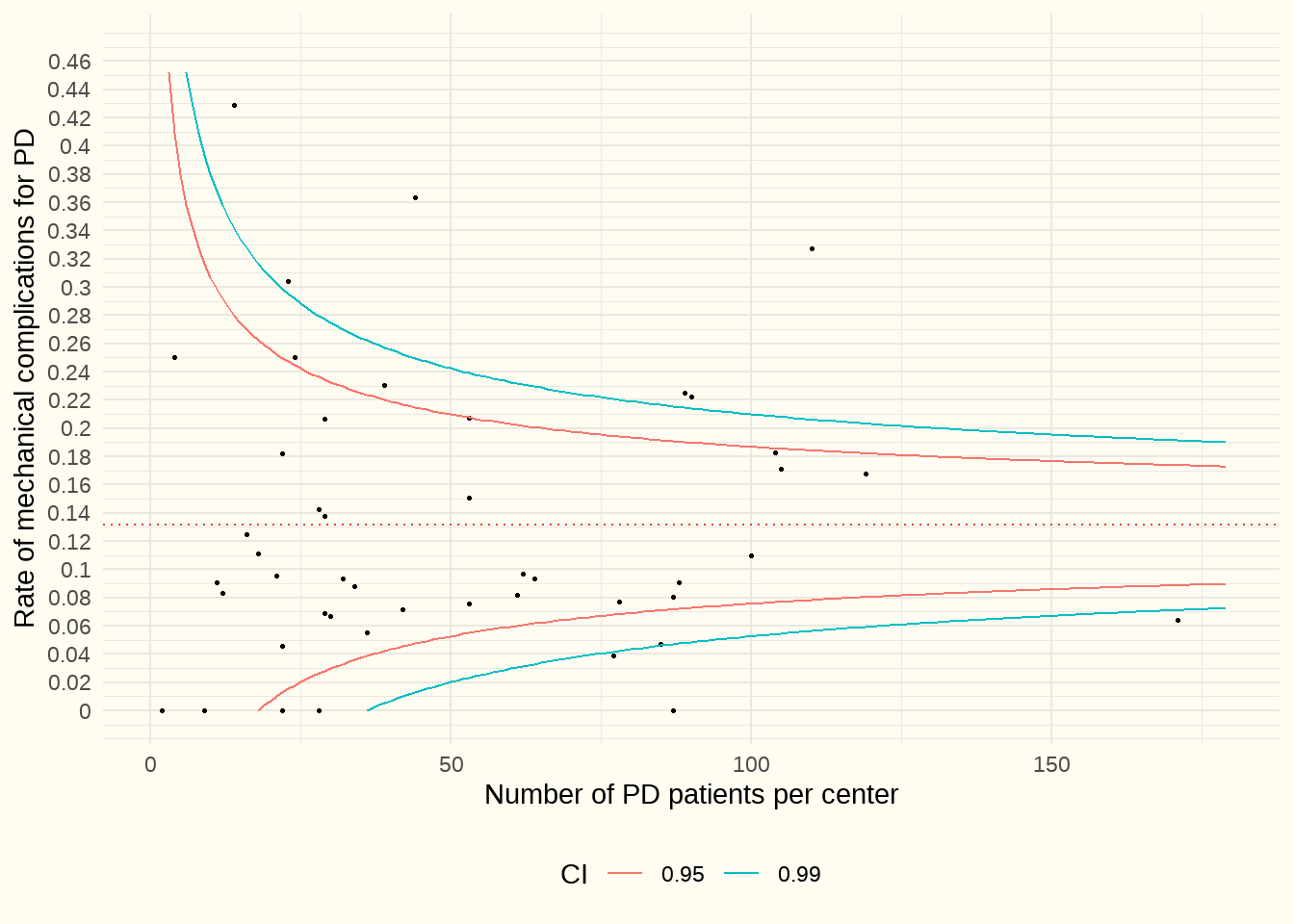
Constatation : La médiane est de 9.4%. Quatre centres se trouvent sous la ligne bleue de l’IC à 0,99 le plus bas et affichent des performances significativement supérieures à la moyenne pondérée (= aberrances positives). D’autre part, 6 centres ont réalisé un score supérieur à l’IC à 0,99 le plus élevé et ont donc obtenu de nettement moins bons résultats sur la base de nos données. Dans de nombreux centres, le nombre absolu des complications a été faible du fait qu’il s’agissait souvent d’un très petit nombre de patients en DP. Dans trois centres, nous n’avons trouvé aucune activité de DP sur la base des pseudocodes de DP. Ces 4 éléments ne sont pas repris dans ce tableau car ils ne permettent pas d’établir de ratios.
Constatation : Il est possible que certains hôpitaux se sont vu envoyer de nombreux patients souffrant de complications et que cela ait eu un impact négatif sur leurs chiffres. Par conséquent, l’objectif de ces évaluations comparatives et, que si un résultat inférieur aux valeurs de référence ne peut pas être expliqué, l’hôpital prenne les mesures d’amélioration qui s’imposent
Discussion : Compte tenu du très faible nombre de patients PD dans certains centres et du fait que nous n’avons pas pu inclure les transferts de patients, nous ne pouvons en tirer aucune conclusion majeure. Le nombre et la sévérité des complications dépendent de la technique utilisée et de l’expérience de la personne chargée du placement (Peppelenbosch et al. 2008; Oza-Gajera, Abdel-Aal, et Almehmi 2022).
7.3 Infections
7.3.1 Épisodes de péritonite
Motivation (PHOTO) : Selon l’initiative SONG-PD, les infections liées à la DP sont un élément clé de l’évaluation de la dialyse péritonéale, car elles sont associées à une morbidité et à une mortalité accrues (Manera et al. 2020). Qui plus est, il s’agit d’un facteur influencé par les différences de pratique. Des aspects de la pratique tels que la DP automatisée, les antibiotiques prophylactiques lors de l’insertion du cathéter, des trajets d’éducation du patient plus longs (>5 jours) et des centres de plus grand volume sont associés à un risque de péritonite plus faible. Cela peut être pris en compte lors de la conception des trajets des patients afin de ne pas dépasser la limite de 0,5 épisode par patient et par an (PPA) fixée par la directive ISPD (Li et al. 2022).
Le tableau ci-dessous illustre l’évolution du nombre de patients PD hospitalisés (admissions de jour et classiques), avec une forme de péritonite comme principal motif d’admission. La « prévalence ponctuelle » concernant les patients PD a été calculée sur la base des pseudocodes de la semaine 20 de la période d’observation.
| description | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Generalized peritonitis | 20 | 16 | 6 | 13 | 15 |
| Peritoneaal abces | 6 | 5 | 8 | 4 | 8 |
| Other peritonitis | 34 | 21 | 24 | 19 | 22 |
| Peritonitis unspecified | 15 | 19 | 17 | 17 | 14 |
| Grand Total | 75 | 61 | 55 | 53 | 59 |
| Prevalence PD patients | 620 | 588 | 585 | 611 | 584 |
Constatation : Le nombre des hospitalisations pour cause de péritonite chez les patients en dialyse DP était plutôt limité. Comme pour tous les graphiques et tableaux, l’étude s’est limitée aux patients admis dans un hôpital disposant d’un centre de dialyse agréé.
Discussion : Ces chiffres peu élevés s’expliquent en partie par le fait que la majorité de ces patients peuvent être traités en ambulatoire. Nous n’avions cependant aucune visibilité sur le nombre de patients ambulatoires dans le cadre de l’audit des données actuel. Nous avons donc posé des questions à ce sujet lors de l’enquête en ligne (voir les items suivants, en moyenne 41,3 % ont été traités en ambulatoire). Un autre aspect qui entre en ligne de compte est que si la péritonite est secondaire à un problème de cathéter, la péritonite n’est généralement pas enregistrée comme le diagnostic principal du séjour mais comme un diagnostic secondaire. Cela se reflète également dans l’écart entre ces chiffres et les résultats de l’enquête en ligne (voir les items suivants).
7.3.1.1 Combien d’épisodes de péritonite liés à la DP par année-patient ont été enregistrés en 2023 ? (EL)
| mean | median | iqr |
|---|---|---|
| 2 | 0.328 | 0.44 |
Constatation : 72 % des répondants ont déclaré n’avoir eu aucun épisode de péritonite lié à la DP par année-patient (PAP) en 2023. Le nombre moyen était de 2, mais la valeur médiane de 0,3 donne un meilleur aperçu. L’intervalle interquartile (iqr) est de 0,4. Trois hôpitaux se distinguent avec respectivement 17, 39 et 311 épisodes de péritonite PAP. Cette dernière valeur n’a pas été incluse dans l’analyse en raison d’une erreur d’enregistrement présumée. Six centres n’ont pas répondu à cette question.
Discussion : L’incidence moyenne globale de la péritonite dans les pays à revenu élevé (HIC) et moyen (MIC) est de 0,6 épisode PAP (Marshall 2022). L’objectif est de ne pas dépasser la limite de 0,5 épisode par patient et par an (PAP) fixée par la directive ISPD (Li et al. 2022). Selon les données de l’enquête en ligne, la majorité des hôpitaux atteignent cet objectif.
7.3.1.2 Quel est le pourcentage (%) de ces épisodes de péritonite par année-patient qui ont été traités en ambulatoire en 2023 (EL) ?
| mean | median | iqr |
|---|---|---|
| 41.3 | 46.43 | 74 |
Selon l’enquête en ligne, en 2023, en moyenne, 41,3 % des épisodes de péritonite ont été traités en ambulatoire. Dans 37 % des cas, cela ne s’est jamais produit en ambulatoire. Pour 4 répondants (9 %), le traitement a toujours été ambulatoire. Six centres n’ont pas répondu à cette question.
7.3.1.3 Quel est le pourcentage de patients sans péritonite par rapport au nombre total de patients DP suivis en 2023 ? (EL)
| mean | median | iqr |
|---|---|---|
| 76 | 79 | 16.25 |
Selon l’enquête en ligne, 76 % des patients PD n’ont pas fait de péritonite en 2023. Deux répondants ont donné un taux d’absence de péritonite de 0 % et 5 répondants ont donné un taux de 100 %. Dans la plupart des centres, ce taux se situe entre 64 et 95 %. Huit centres n’ont pas répondu à cette question.
Constatation : Certaines des différences constatées peuvent s’expliquer par les différences au niveau du nombre de patients en DP entre les centres.
7.3.1.4 Quel était le pourcentage d’épisodes de péritonite à culture négative par rapport au nombre total d’épisodes de péritonite en 2023 ? (EL)
| mean | median | iqr |
|---|---|---|
| 12.7 | 0 | 19.09 |
Selon l’enquête en ligne, en 2023, le pourcentage moyen des épisodes de péritonite à culture négative était de 12,7 %. Chez 64 % des répondants, le nombre d’épisodes de péritonite à culture négative était de 0 %, et chez 1 répondant il était de 100%. Cinq centres n’ont pas répondu à cette question.
Constatation : Si on ne peut pas obtenir de culture positive, on parle de péritonite à culture négative. Dans ce cas, l’étiologie peut également être de nature non infectieuse, notamment, due à un agent chimique (p. ex. l’icodextrine). La capacité à identifier un germe dans au moins 85 % des diagnostics de péritonite (ISPD) est une preuve de « bonne pratique ». Les péritonites à culture négative doivent donc être de préférence <15 %, ce qui était généralement le cas.
7.4 Germes trouvés et antibiogramme
Motivation (PHOTO) : Idéalement, l’étiologie de la péritonite doit être mentionnée. Il est utile de toujours essayer d’identifier et de noter le germe causal. Avant l’instauration d’un traitement antibiotique, il convient de procéder à une inspection minutieuse du cathéter de DP et de prélever les échantillons nécessaires à la culture (Li et al. 2022; Chow et al. 2023).
Pendant l’audit sur place, il a été vérifié qu’un antibiogramme a été réalisé en cas de culture positive du liquide PD. Sur les 10 dossiers dans lesquels une culture positive du liquide de DP a été mentionnée, 8 comportaient un antibiogramme. Dans ces 8 dossiers, les antibiotiques étaient conformes à l’antibiogramme.
7.4.1 Infections liées à la voie d’accès
Le graphique en entonnoir ci-dessous illustre le rapport entre le nombre d’hospitalisations dues à des infections liées à la voie d’accès (ICD10BE code T85.71) et le nombre de patients DP dans ce centre (axe Y). La taille du centre en fonction du nombre de patients PD est reprise sur l’axe X. Nous ne nous limitons donc pas ici à la période de 30 jours suivant le placement d’un cathéter de DP, comme indiqué plus haut (voir Section 7.2). Nous avons utilisé les pseudocodes du doc P pour la période d’observation du 1/1/2017 au 31/12/2021.
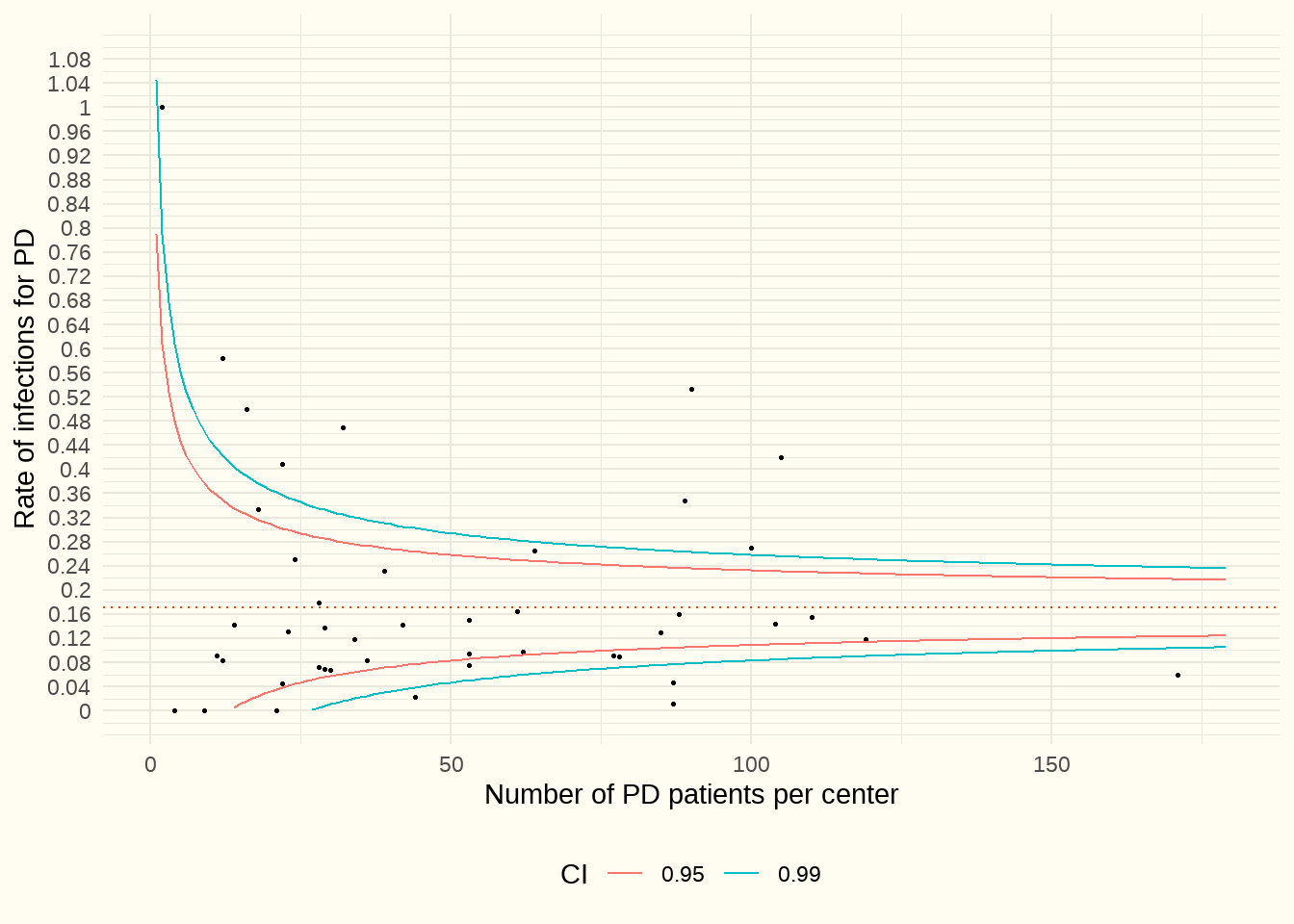
Constatation : La médiane est de 13%. Nous constatons qu’il y a plus d’aberrances négatives que sur le graphique relatif aux infections <30 jours après le placement (cfr. Section 7.2). 4 centres n’avaient aucun patient en DP et ne sont pas repris sur le graphique.
Discussion : Le benchmarking individuel permet aux hôpitaux d’éventuellement éviter davantage d’hospitalisations. D’une part, en prévenant les infections et, d’autre part, en mettant en place des politiques de soins qui facilitent au maximum les traitements ambulatoires.
7.5 Suivi de laboratoire
7.5.1 Quelle(s) mesure(s) avez-vous mise(s) en place pour contrôler l’adéquation de la dialyse péritonéale ? (EL)
Motivation (KPI) : L’adéquation du processus de dialyse est exprimée par la clairance péritonéale - Kt/V (à savoir clairance, temps et volume). On obtient ainsi le taux de clairance d’une substance donnée, dans la plupart des cas la créatinine et l’urée. Le test Kt/V est effectué sur le « dialysat » obtenu après 24 heures de dialyse. Une cinétique de l’urée (Kt/V hebdomadaire) supérieure à 1,7 définit généralement une dialyse péritonéale (DP) adéquate. L’adéquation de la DP dépend de la fonction rénale résiduelle et de la clairance de la DP. Le maintien de la fonction rénale résiduelle et des caractéristiques de la membrane péritonéale permet de maintenir l’adéquation de la DP (Lew 2018).
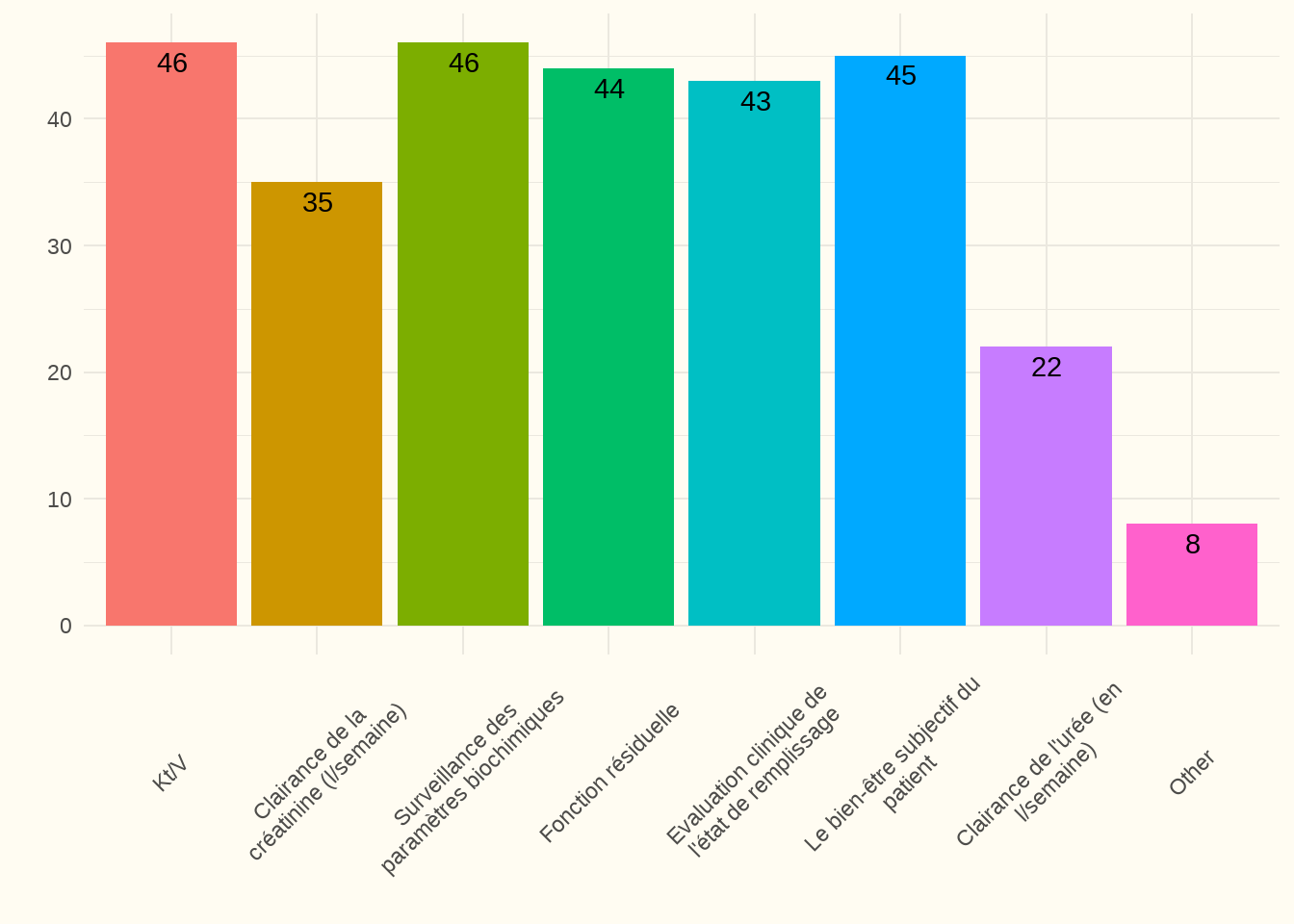
Constatation : « Kt/V » et « suivi des paramètres biochimiques » ont obtenu les meilleurs résultats à cette question (92 %). Notons également que 88 % des répondants déterminent la fonction résiduelle. Enfin, 90 % des répondants ont mentionné aussi suivre le paramètre « bien-être des patients ». Deux centres n’ont pas répondu à cette question. La grande majorité des centres (84 %) ont indiqué qu’ils effectuaient ce suivi de manière systématique une fois ou plusieurs fois par an. Un seul centre n’a pas répondu à cette question.
Remarque du panel d’experts : pour calculer le Kt/V total, la fonction rénale résiduelle est nécessaire, et pourtant nous constatons une légère divergence entre les deux réponses.
Pendant l’audit sur place, on a systématiquement examiné les paramètres suivis dans les dossiers des patients. Cet examen a donné des résultats divergents. Dans la majorité des centres, ce test a été effectué chaque année par Kt/V. En outre, plusieurs centres ont déclaré avoir effectué le test d’équilibration péritonéale (PET) (2 à 3 mois après le début du traitement, et ensuite tous les 1 à 2 ans (5/24)). Enfin, la collecte d’urine sur 24 heures et uniquement le suivi anamnestique ont également été mentionnés.
Discussion : Le PET est un test standardisé de 4 heures qui permet de quantifier la perméabilité de la membrane péritonéale. Il est préférable de l’effectuer entre 6 et 12 semaines après le début de la DP et de le réévaluer tous les six mois ou tous les ans. Outre les facteurs qui peuvent être influencés de l’extérieur, l’efficacité du processus de dialyse dépend également de facteurs propres au patient, entre autres le poids, la perméabilité de la membrane péritonéale et la fonction rénale résiduelle. La perméabilité montre une variabilité à la fois inter- et intra-individuelle. Les caractéristiques de la membrane peuvent changer au fil des ans en raison du traitement de DP et de ses complications potentielles, notamment les péritonites récurrentes (Morelle et al. 2021). La fréquence de réalisation du PET est plus faible dans nos centres de dialyse.
Commentaires du panel d’experts : L’utilité du Kt/V fait l’objet d’un débat (y compris au niveau international), mais il n’existe pas d’autre moyen de déterminer l’évolution de l’adéquation de la dialyse. Comme pour l’HD, l’objectif du Kt/V ne doit pas être d’atteindre une valeur cible absolue, mais plutôt d’évaluer l’évolution de la membrane de dialyse et d’estimer la nécessité d’ajuster le traitement.
7.6 Survie liée aux différentes techniques de dialyse
Il s’agit là d’un aspect important. Cependant, nous n’avons pas pu la calculer à partir des données dont nous disposions.
7.7 Raisons pour lesquelles il est mis fin à la DP
Pendant l’audit sur place, nous avons demandé aux responsables quelles étaient les trois raisons les plus courantes de l’arrêt du traitement par DP.
La réponse la plus fréquente était « défaillance de la membrane ou autre problème mécanique » (17/24), suivie par les infections récurrentes (13/24) et la transplantation (10/24). Les aspects suivants ont également été abordés : l’aidant proche ou le patient considèrent que ce n’est plus tenable (8/24), un problème de cathéter (5/24), un trajet de soins palliatifs et le décès (4/24), une fuite permanente (3/24), une situation sociale ayant exigé le placement dans un centre de soins résidentiels (CSR) (2/24), des problèmes psychosociaux (y compris le fait de ne pas vouloir faire face à la maladie à domicile) (2/24), le manque de personnel infirmier pour superviser correctement le patient à domicile et, enfin, l’impact sur l’image corporelle (en particulier chez les femmes).
Constatation : Les principales raisons invoquées sont toutes de nature technique.